Analyse GC-MS des phtalates : comparaison de 7 phases stationnaires
Abstract
Les phtalates sont omniprésents dans notre environnement et doivent être contrôlés en raison de leur impact négatif potentiel sur la santé humaine. Il est donc indispensable de pouvoir les séparer et les détecter. La chromatographie en phase gazeuse est la technique de choix pour séparer ces composés. Elle peut être associée à différents modes de détection, notamment la capture d’ électrons (ECD), l’ionisation de flamme (FID) et la spectrométrie de masse (SM). Dans cette étude, le logiciel de modélisation chromatographique Pro EZGC a été utilisé pour identifier la meilleure phase stationnaire et déterminer les conditions optimales pour l’analyse GC-MS des phtalates. Sept phases stationnaires ont été étudiées : Rtx-440, Rxi-XLB, Rxi-5ms, Rtx-50, Rxi-35Sil MS, Rtx-CLPesticides et Rtx-CLPesticides2. Les résultats obtenus ont été comparés. Dans tous les cas les 18 phtalates répertoriés dans les méthodes EPA (Environmental Protection Agency) et/ou européennes ont été analysés en moins de 6 minutes. Par ailleurs, 37 phtalates ont également été analysés en moins de 40 minutes grâce à une méthode optimisée. La meilleure résolution de ce mélange complexe de phtalates a été obtenue avec les colonnes Rtx-440, phase exclusive Restek et Rxi-XLB.
Introduction
Les phtalates sont couramment utilisés comme plastifiants dans divers produits industriels. Certains d’entre eux sont cependant considérés comme des perturbateurs endocriniens [1] et sont liés à de nombreuses pathologies comme les malformations congénitales [2] ; l’hypertension artérielle chez les enfants [3] ; les cardiopathies hypertensives induites par la grossesse [4] ; les troubles respiratoires [5] et l'obésité [6]. L’Union Européenne (UE) et l’EPA ont restreint l’utilisation des phtalates les plus nocifs (Tableau I).
La GC-MS est couramment utilisée pour l'analyse des phtalates car elle est simple, rapide et économique. La détection par spectrométrie de masse permet de déterminer la nature des phtalates. Il est essentiel de choisir une colonne chromatographique garantissant de bonnes séparations car les similitudes structurelles entre les phtalates peuvent rendre difficiles l’identification et la quantification MS. Par exemple, de nombreux phtalates partagent un même ion de base (m/z 149), ce qui complique l’identification et la quantification des phtalates coélués. La présence dans les mélanges de phtalates de grade technique et d’isomères constituent une difficulté supplémentaire.
Un article publié récemment passait en revue les colonnes GC et LC les plus fréquemment utilisées pour l’analyse des phtalates [7]. Selon ce document, la GC-MS produit une meilleure résolution de ces composés par rapport à la LC-MS. Les colonnes GC les plus couramment utilisées sont dans l’ordre : de type 5% phényle siloxane, XLB, 35% phényle siloxane, 17, 50% phényle siloxane et 1 (100% méthyle siloxane). Les séparations obtenues avec chaque phase stationnaire peuvent être optimisées en ajustant les conditions analytiques. Dans la pratique, ces ajustements constituent un travail long et fastidieux. Le logiciel de modélisation Pro EZGC permet d’ optimiser rapidement les conditions analytiques (par exemple, le choix du gaz vecteur, son débit, le programme de température, les dimensions de la colonne et de la précolonne) pour obtenir les meilleurs résultats dans le temps le plus court possible, avec chacune des phases stationnaires. Pour cette étude, une bibliothèque de 37 phtalates (Tableau II) a été créée dans le programme Pro EZGC pour être ensuite utilisée avec les sept phases stationnaires : Rtx-440, Rxi-XLB, Rxi-5ms, Rtx-50, Rxi-35Sil MS, Rtx-CLPesticides et Rtx-CLPesticides2.
Étalons analytiques
La solution-étalon d’esters de phtalate EPA 8061A (réf. 33227) contenant 15 des analytes-cibles, chacun à une concentration de 1 000 μg/ml, a été utilisée comme étalon principal. Le benzoate de benzyle (réf. 31847) était l’étalon interne. Tous les autres étalons proviennent de la société Chem Service.
Appareillage
L’analyse GC-MS a été réalisée avec un Shimadzu QP2010 Plus. Chacune des sept colonnes Restek (dans leur configuration de 30 m × 0,25 mm × 0,25 μm - 0,20 μm pour la colonne Rtx-CLPesticides2) est tour à tour installée dans l’appareil. Le logiciel Pro ZGC (sous Windows) a permis de déterminer les conditions optimales pour chaque colonne. Les performances des colonnes ont ensuite été comparées en procédant à l’analyse réelle des solutions préparées, en appliquant pour chaque colonne les mêmes conditions analytiques qui avaient produit les meilleures séparations. Cette comparaison permet de mieux comprendre les différences de sélectivité entre les colonnes. Les descriptions détaillées des colonnes et les conditions analytiques sont présentées respectivement dans le Tableau I et le Tableau III.
Préparation des échantillons
Les étalons ont été dissous et dilués dans du chlorure de méthylène pour préparer des solutions à 50 μg/ml (80 μg/ml pour l'étalon interne de benzoate de benzyle). Pour ces préparations, toute vaisselle ou accessoires en plastique ont été proscrits au profit de matériel en verre (flacons jaugés, seringues, fioles, etc.).
Résultats et discussion
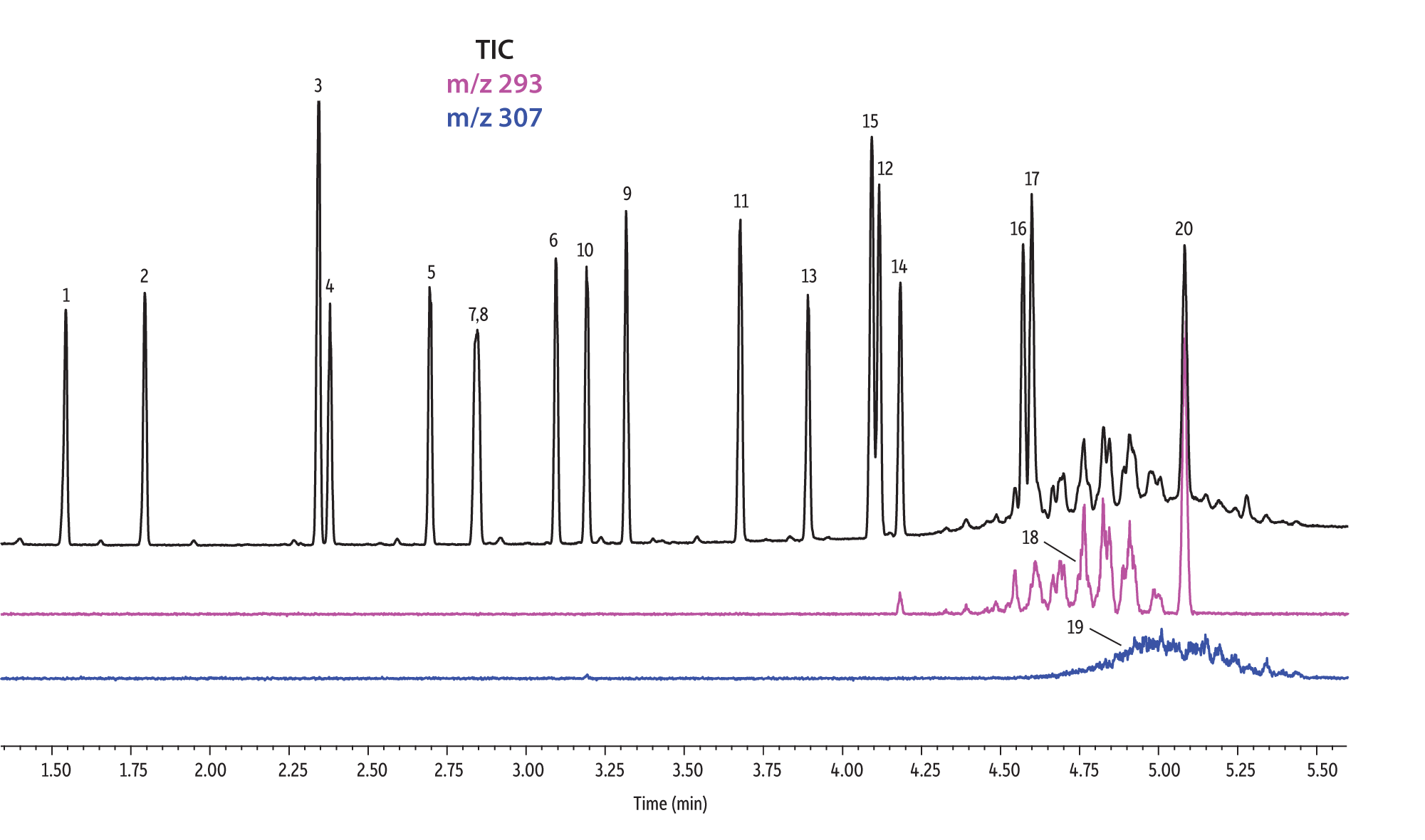
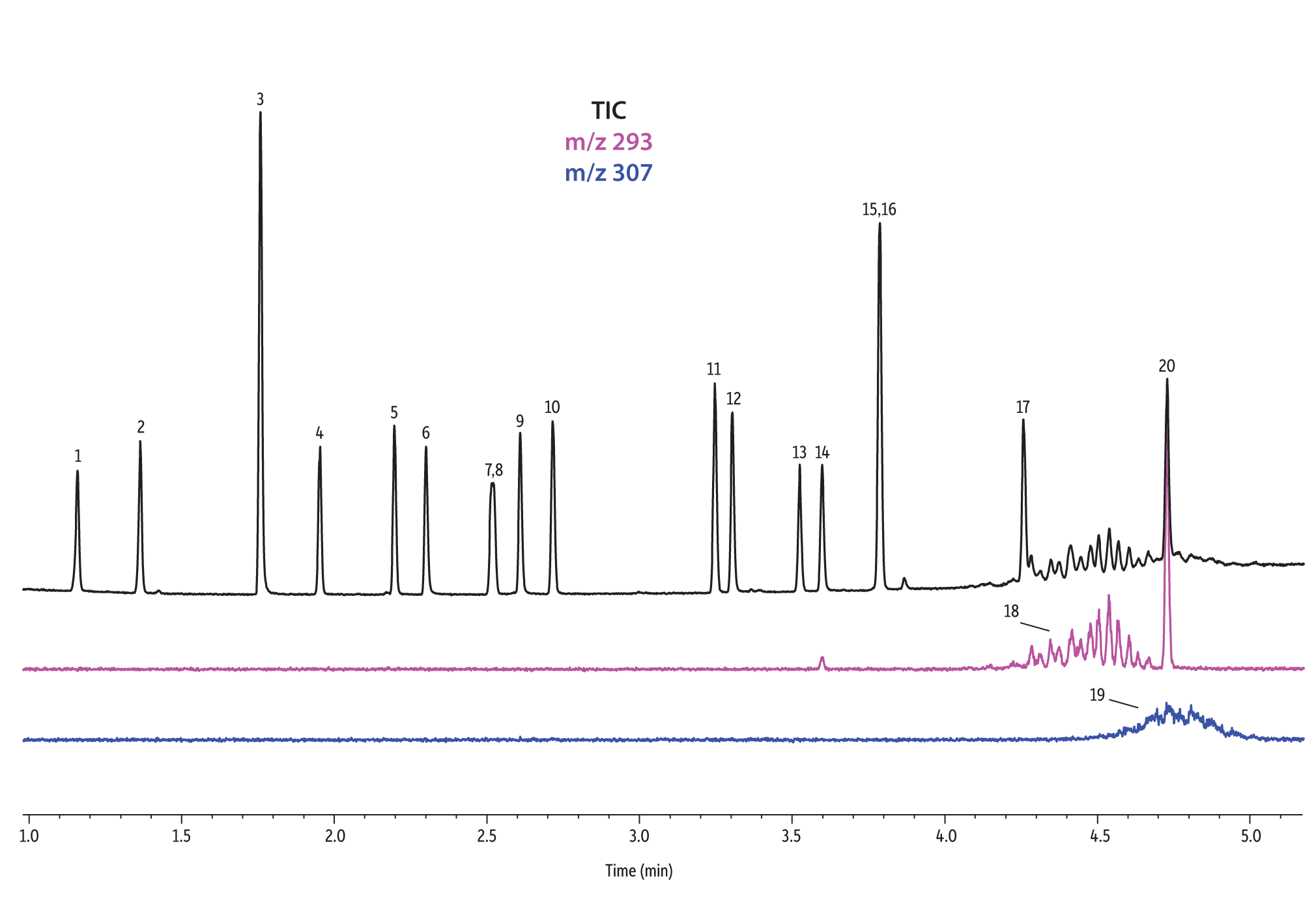
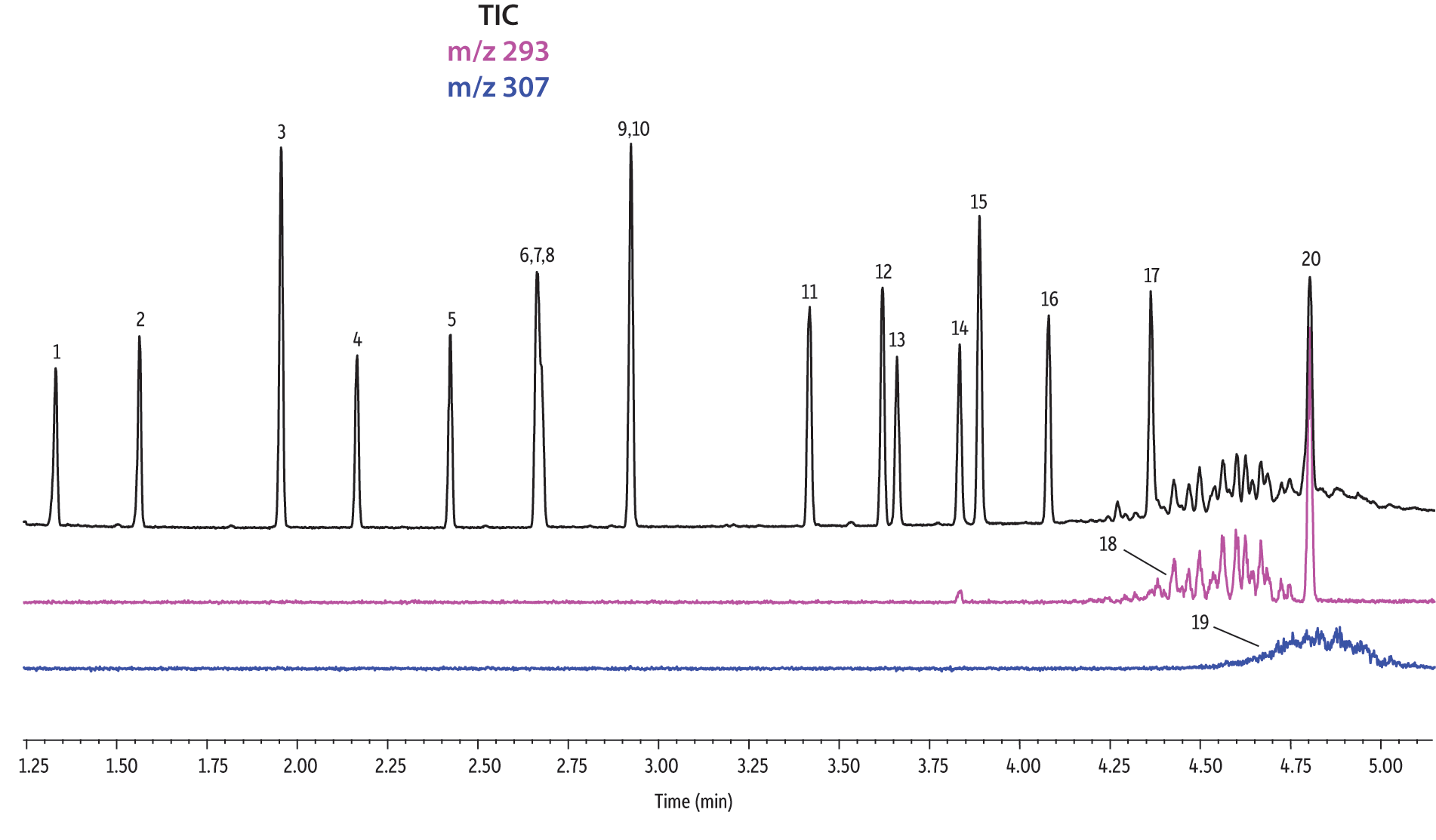
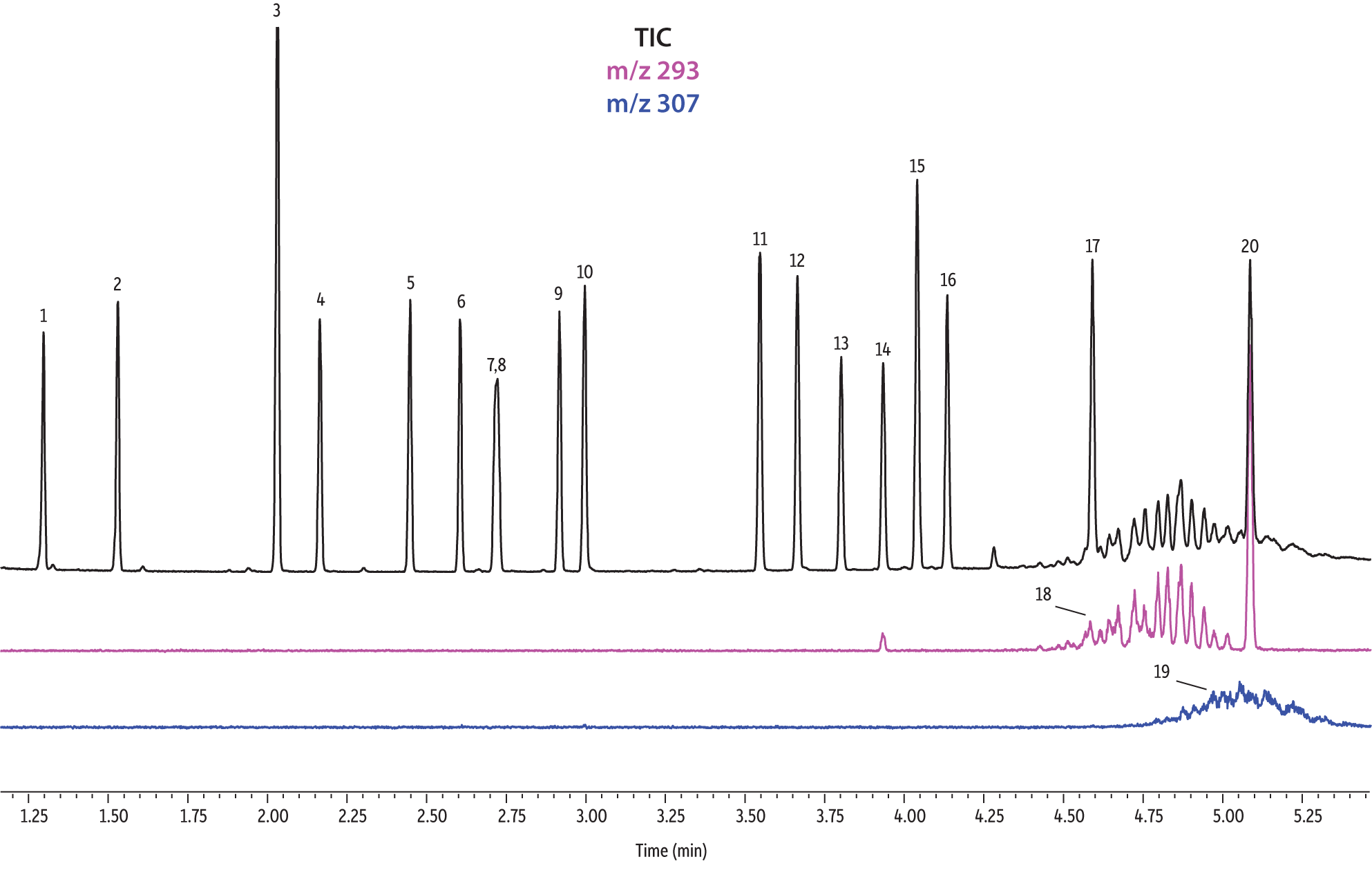
Nous avons comparé la performance de sept colonnes pour la séparation de 37 phtalates. Le logiciel Pro EZGC a permis de prévoir les temps de rétention pour chaque phase stationnaire en utilisant les mêmes conditions analytiques. Ces conditions, décrites dans le Tableau I, sont celles qui ont permis d’obtenir les meilleurs résultats parmi l’ensemble de conditions spécifiques optimisées pour chaque colonne. Nous avons considéré qu’il y avait "coélution" lorsque la résolution entre deux composés était inférieure à 1,5. Le temps d’analyse total était inférieur à 6 minutes. Pour confirmer les temps de rétention prévus par le logiciel Pro EZGC, des analyses ont été faites avec chaque phase stationnaire dans les mêmes conditions que celles "conseillées" par le logiciel (Figure 1). Étant donné que la longueur réelle des colonnes n’était pas exactement de 30 mètres, comme dans la simulation, les temps de rétention absolus étaient légèrement différents par rapport aux valeurs prévues. L'ordre d’élution et les coélutions étaient conformes à ce qu’avait prévu le logiciel. Les colonnes Rtx-440, Rxi-XLB, Rtx-CLPesticides et Rxi-35Sil MS ont séparé à la ligne de base les 37 phtalates répertoriés. Les deux isomères de phtalate de bis[4-methyle-2-pentyle] n’ont été résolus sur aucune des sept phases. L'ordre d’élution était comparable sur les colonnes Rtx-440, Rxi-XLB, Rtx-CLPesticides et Rxi-5ms.
Nous avons observé des différences dans l’ordre d’élution avec les phases Rxi-35Sil MS et Rtx-50. L’ordre d’élution a notamment changé avec la colonne Rxi-35Sil MS pour ces quatre paires de composés : les isomères de phtalate de bis(2-methoxyéthyle) et bis(4-méthyle-2-pentyle) (pics 6 et 7/8), de bis(2-éthoxyéthyle) et di-n-pentyle (pics 9 et 10), de benzyle butyle et d’hexyle-2-éthylhexyle (pics 12 et 13) et de bis(2-butoxyéthyle) et bis(2-éthylhexyle) (pics 14 et 15).
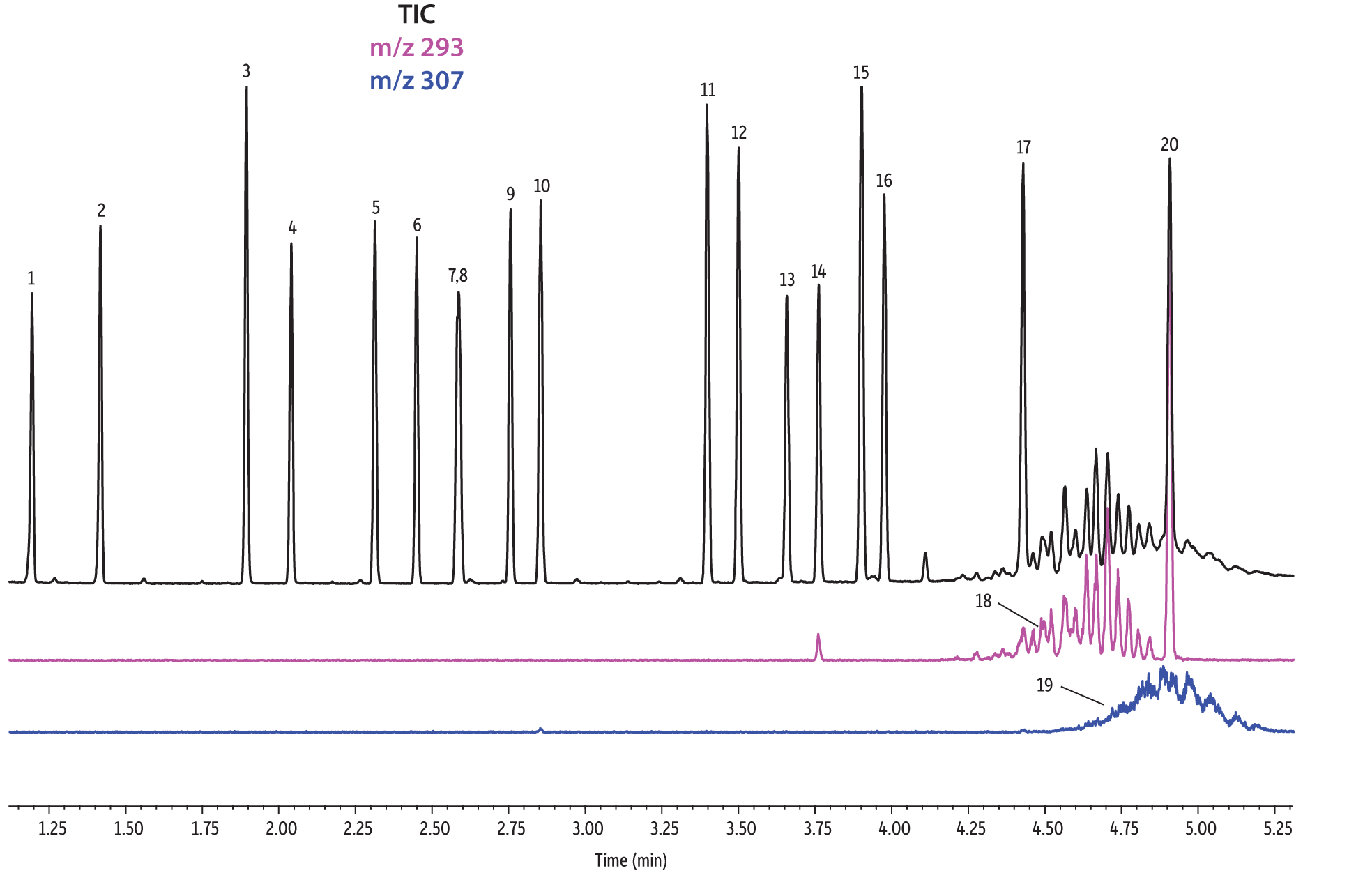
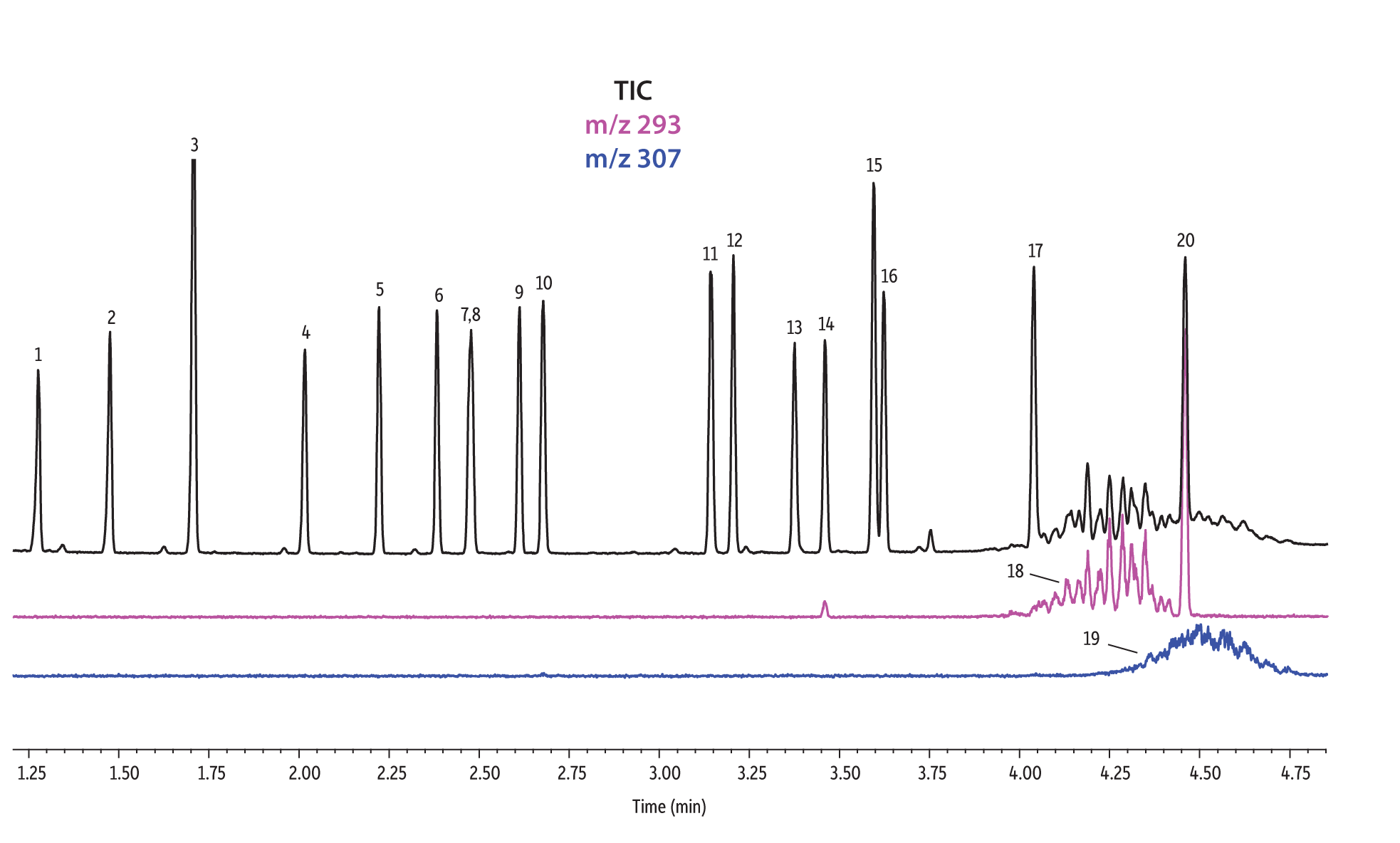
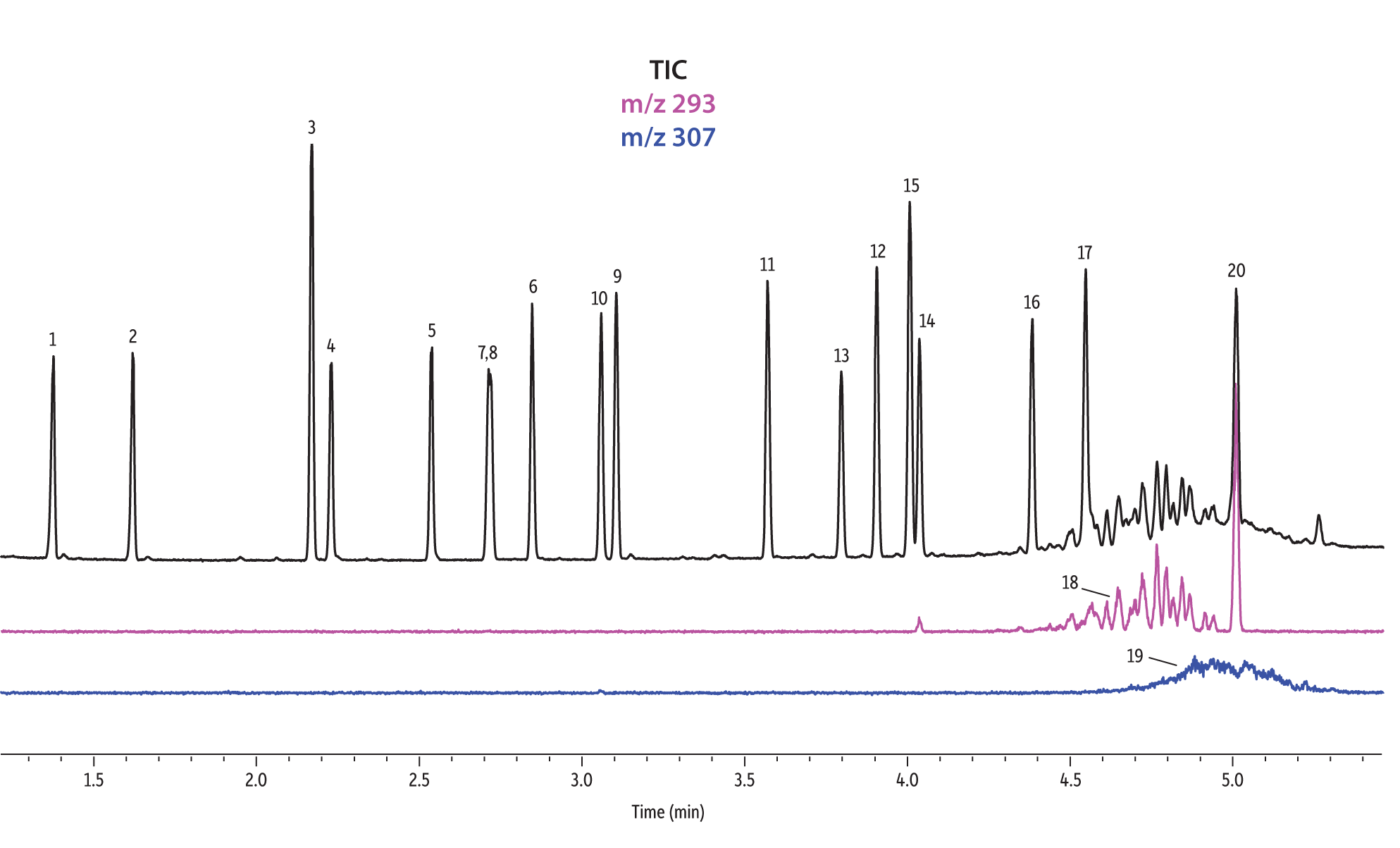
Les colonnes Rtx-440 et Rxi-XLB présentaient globalement les meilleures séparations dans ces conditions. Les pics qui ont coélué avec les autres colonnes étaient bien résolus avec les colonnes Rtx-440 et Rxi-XLB. Les paires non résolues avec les autres phases sont les phtalates de bis(2-éthylhexyle) et de dicyclohexyle (pics 15 et 16) avec la colonne Rxi-5ms ; les phtalates de bis(2-éthylhexyle) et de benzyle butyle (pics 15 et 12) avec la colonne Rtx-50 ; et les phtalates de bis(2-méthoxyéthyle) et de bis[4-méthyle-2-pentyle] (pics 6 et 7,8) ainsi que le phtalate de bis(2-ethoxyéthyle) et de di-n-pentyle (pics 9 et 10) sur la colonne Rtx-CLPesticides2. Dans les mélanges d’isomères de grade technique, il est possible d’identifier des groupes d’isomères, tels que le phtalate de diisononyle et le phtalate de diisodécyle (pics 18 et 19). Il est cependant impossible de résoudre complètement chaque isomère au sein de ces groupes. Heureusement, leurs ions spécifiques permettent leur identification et quantification, comme le m/z 293 pour le phtalate de diisononyle et le m/z 307 pour le phtalate de diisodecyle (Figure 1).
Tableau I : Temps de rétention prévus par le logiciel Pro EZGC avec 7 colonnes Restek
Colonne : 30 m x 0,25 mm x 0,25 μm (0,20 μm pour la colonne Rtx-CLPesticides2)
Vitesse linéaire constante : 66,7 cm/sec
Four : 200 °C (isotherme de 0,5 min) à 330 °C (320 °C pour la colonne Rtx-50) à 30 °C/min (isotherme de 1 min)
| Peak # | Name | Listed | Retention Time (min) | CAS # | Purity | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Rtx-440 (cat. 12923) |
Rxi-XLB (cat. 13723) |
Rtx- CLPesticides (cat. 11123) |
Rxi-35Sil MS (cat. 13823) | Rtx-50 (cat. 10523) |
Rxi-5ms (cat. 13423) |
Rtx- CLPesticides2 (cat. 11323) |
|||||
| 1 | Dimethyl phthalate* | EPA 8061A, EPA Priority | 1.28 | 1.16 | 1.14 | 1.29 | 1.46 | 1.10 | 1.23 | 131-11-3 | Neat |
| 2 | Diethyl phthalate* | EPA 8061A, EPA Priority, EU | 1.54 | 1.39 | 1.33 | 1.55 | 1.73 | 1.30 | 1.47 | 84-66-2 | Neat |
| 3 | Benzyl benzoate | Internal Standard | 2.11 | 1.87 | 1.56 | 2.17 | 2.31 | 1.70 | 1.88 | 120-51-4 | Neat |
| 4 | Diisobutyl phthalate* | EPA 8061A | 2.25 | 2.04 | 1.88 | 2.21 | 2.34 | 1.91 | 2.10 | 84-69-5 | Neat |
| 5 | Di-n-butyl phthalate* | EPA 8061A, EPA Priority | 2.58 | 2.33 | 2.10 | 2.53 | 2.69 | 2.17 | 2.38 | 84-74-2 | Neat |
| 6 | Bis(2-methoxyethyl) phthalate* | EPA 8061A | 2.74 | 2.48 | 2.26 | 2.86 | 3.10 | 2.27 | 2.63 | 117-82-8 | Neat |
| 7 | Bis(4-methyl-2-pentyl) phthalate isomer 1* | EPA 8061A | 2.85 | 2.62 | 2.37 | 2.71 | 2.83 | 2.50 | 2.64 | 84-63-9 | Neat |
| 8 | Bis(4-methyl-2-pentyl) phthalate isomer 2* | EPA 8061A | 2.86 | 2.63 | 2.37 | 2.72 | 2.84 | 2.51 | 2.65 | 84-63-9 | Neat |
| 9 | Bis(2-ethoxyethyl) phthalate* | EPA 8061A | 3.08 | 2.80 | 2.51 | 3.13 | 3.33 | 2.59 | 2.90 | 605-54-9 | Neat |
| 10 | Di-n-pentyl phthalate* | EPA 8061A | 3.16 | 2.91 | 2.58 | 3.08 | 3.21 | 2.71 | 2.89 | 131-18-0 | Neat |
| 11 | Di-n-hexyl phthalate* | EPA 8061A | 3.73 | 3.46 | 3.07 | 3.61 | 3.69 | 3.25 | 3.42 | 84-75-3 | Neat |
| 12 | Butyl benzyl phthalate* | EPA 8061A, EPA Priority, EU | 3.85 | 3.56 | 3.12 | 3.93 | 4.13 | 3.30 | 3.63 | 85-68-7 | Neat |
| 13 | Hexyl 2-ethylhexyl phthalate | EPA 8061A | 3.98 | 3.72 | 3.29 | 3.83 | 3.92 | 3.52 | 3.66 | 75673-16-4 | Technical |
| 14 | Bis(2-butoxyethyl) phthalate* | EPA 8061A | 4.12 | 3.82 | 3.39 | 4.08 | 4.21 | 3.60 | 3.85 | 117-83-9 | Neat |
| 15 | Bis(2-ethylhexyl) phthalate* | EPA 8061A | 4.21 | 3.95 | 3.52 | 4.05 | 4.12 | 3.82 | 3.91 | 117-81-7 | Neat |
| 16 | Dicyclohexyl phthalate* | EPA 8061A, EPA Priority, EU | 4.33 | 4.04 | 3.55 | 4.42 | 4.58 | 3.78 | 4.08 | 84-61-7 | Neat |
| 17 | Di-n-octyl phthalate* | EPA 8061A, EPA Priority, EU | 4.76 | 4.50 | 3.97 | 4.59 | 4.62 | 4.24 | 4.39 | 117-84-0 | Neat |
| 18 | Diisononyl phthalate | EU | 5.10 | 4.84 | 4.23 | 4.84 | 4.84 | 4.50 | 4.64 | 68515-48-0 | Isomer mix |
| 19 | Diisodecyl phthalate | EU | 5.20 | 4.95** | 4.42 | 5.01 | 5.18 | 4.71 | 4.90 | 26761-40-0 | Isomer mix |
| 20 | Dinonyl phthalate* | EPA 8061A | 5.24 | 4.95** | 4.39 | 5.04 | 5.10 | 4.72 | 4.83 | 84-76-4 | Neat |
Remarque : les zones grisées indiquent les coélutions (Rs<1,5).
*Ces composés figurent dans le mélange d’esters de phtalate de la Méthode 8061A EPA Restek (réf. 33227).
**Les pics 19 et 20 sont non-isobariques et peuvent être séparés en mode SIM.
Nous avons observé des différences dans l’ordre d’élution avec les phases Rxi-35Sil MS et Rtx-50. L’ordre d’élution a notamment changé avec la colonne Rxi-35Sil MS pour ces quatre paires de composés : les isomères de phtalate de bis(2-methoxyéthyle) et bis(4-méthyle-2-pentyle) (pics 6 et 7/8), de bis(2-éthoxyéthyle) et di-n-pentyle (pics 9 et 10), de benzyle butyle et d’hexyle-2-éthylhexyle (pics 12 et 13) et de bis(2-butoxyéthyle) et bis(2-éthylhexyle) (pics 14 et 15).
Les colonnes Rtx-440 et Rxi-XLB présentaient globalement les meilleures séparations dans ces conditions. Les pics qui ont coélué avec les autres colonnes étaient bien résolus avec les colonnes Rtx-440 et Rxi-XLB. Les paires non résolues avec les autres phases sont les phtalates de bis(2-éthylhexyle) et de dicyclohexyle (pics 15 et 16) avec la colonne Rxi-5ms ; les phtalates de bis(2-éthylhexyle) et de benzyle butyle (pics 15 et 12) avec la colonne Rtx-50 ; et les phtalates de bis(2-méthoxyéthyle) et de bis[4-méthyle-2-pentyle] (pics 6 et 7,8) ainsi que le phtalate de bis(2-ethoxyéthyle) et de di-n-pentyle (pics 9 et 10) sur la colonne Rtx-CLPesticides2. Dans les mélanges d’isomères de grade technique, il est possible d’identifier des groupes d’isomères, tels que le phtalate de diisononyle et le phtalate de diisodécyle (pics 18 et 19). Il est cependant impossible de résoudre complètement chaque isomère au sein de ces groupes. Heureusement, leurs ions spécifiques permettent leur identification et quantification, comme le m/z 293 pour le phtalate de diisononyle et le m/z 307 pour le phtalate de diisodecyle (Figure 1).
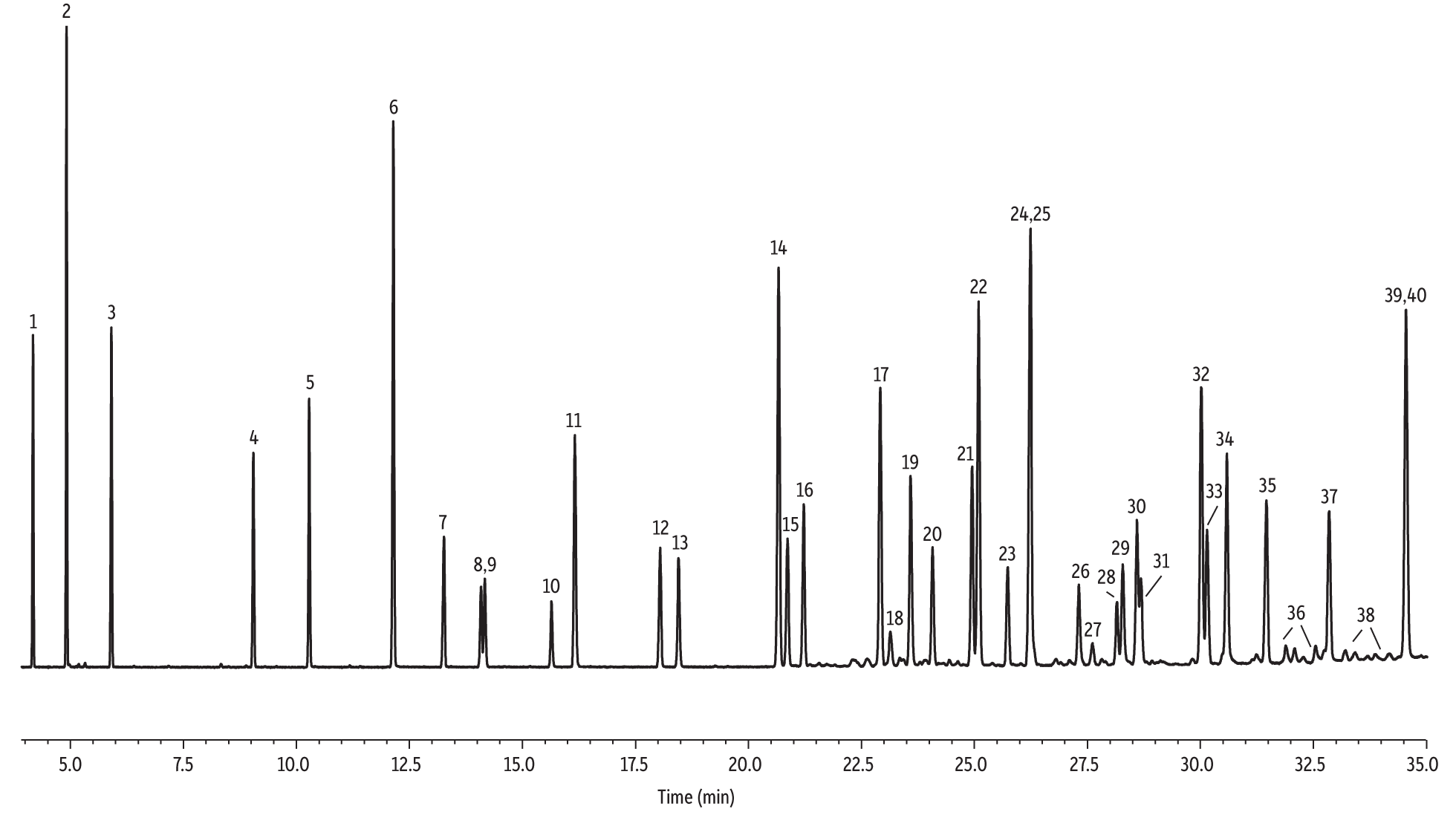
Une comparaison plus complète des sept phases stationnaires a également été réalisée pour la séparation de 37 phtalates (40 pics en tout, dont trois isomères) en utilisant les temps de rétention prévus par le programme Pro EZGC (Tableau II). Les conditions analytiques reprises dans le Tableau III ont permis la séparation de 34 des 40 pics avec les colonnes Rtx-440 et Rxi-XLB en moins de 40 minutes, les deux phases présentant des différences d’ordre d’élution. Le chromatogramme obtenu avec la colonne Rtx-440 est présenté en Figure 2. Pour certaines paires qui n’étaient pas résolues à la ligne de base, la résolution reste suffisante pour une analyse qualitative. Il n’a pas été possible d’établir des conditions analytiques qui soient optimales pour toutes les phases. Le programme qui produit les meilleurs résultats en termes de durée de l’analyse et de nombre de pics résolus a été retenu pour réaliser cette comparaison. Ces conditions peuvent être optimisées avec le logiciel Pro EZGC si d’autres composés doivent être séparés. Considérant les durées d’analyse et les séparations obtenues, les colonnes Rtx-440 et Rxi-XLB apparaissent comme les meilleurs choix pour l’analyse des phtalates.
Tableau II : Temps de rétention prévus par le logiciel Pro EZGC avec 7 colonnes Restek
Colonne : 30 m x 0,25 mm x 0,25 μm (0,20 μm pour la colonne Rtx-CLPesticides2)
Vitesse linéaire constante : 48 cm/sec
Four : 150 °C (isotherme de 0,8 min) à 200 °C à 5 °C/min à 275 °C à 3 °C/min (isotherme de 2 min)
| Peak # | Name | Listed | Retention Time (min) | CAS # | Purity | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Rtx-440 (cat. 12923) |
Rxi-XLB (cat. 13723) |
Rxi-5ms (cat. 13423) | Rtx-50 (cat. 10523) | Rxi-35Sil MS (cat. 13823) | Rtx- CLPesticides (cat. 11123) |
Rtx- CLPesticides2 (cat. 11323) |
|||||
| 1 | Dimethyl phthalate* | EPA 8061A, EPA Priority | 4.606 | 3.924 | 3.294 | 5.912 | 4.902 | 3.75 | 4.334 | 131-11-3 | Neat |
| 2 | Dimethyl isophthalate | — | 5.491 | 4.690 | 3.85 | 6.35 | 5.498 | 4.174 | 4.793 | 1459-93-4 | Neat |
| 3 | Diethyl phthalate* | EPA 8061A, EPA Priority, EU | 6.537 | 5.642 | 4.762 | 7.809 | 6.785 | 5.24 | 6.106 | 84-66-2 | Neat |
| 4 | Benzyl benzoate | Internal Standard | 9.931 | 8.667 | N/A | 11.099 | N/A | 6.725 | 8.583 | 120-51-4 | Neat |
| 5 | Diisobutyl phthalate* | EPA 8061A | 11.185 | 10.029 | 8.817 | 11.817 | 11.008 | 9.101 | 10.333 | 84-69-5 | Neat |
| 6 | Di-n-butyl phthalate* | EPA 8061A, EPA Priority | 13.152 | 11.850 | 10.405 | 14.031 | 13.094 | 10.481 | 12.029 | 84-74-2 | Neat |
| 7 | Bis(2-methoxyethyl) phthalate* | EPA 8061A | 14.343 | 12.784 | 11.045 | 17.095 | 15.424 | 11.54 | 13.725 | 117-82-8 | Neat |
| 8 | Bis(4-methyl-2-pentyl) phthalate isomer 1* | EPA 8061A | 15.192 | 13.754 | 12.47 | 15.184 | 14.454 | 12.166 | 13.825 | 84-63-9 | Neat |
| 9 | Bis(4-methyl-2-pentyl) phthalate isomer-2* | EPA 8061A | 15.350 | 13.828 | 12.55 | 15.277 | 14.542 | 12.233 | 13.906 | 84-63-9 | Neat |
| 10 | Bis(2-ethoxyethyl) phthalate* | EPA 8061A | 16.910 | 15.132 | 13.199 | 19.063 | 17.59 | 13.186 | 15.875 | 605-54-9 | Neat |
| 11 | Di-n-pentyl phthalate* | EPA 8061A | 17.454 | 15.880 | 13.856 | 17.974 | 17.128 | 13.588 | 15.768 | 131-18-0 | Neat |
| 12 | Butyl cyclohexyl phthalate | — | 19.452 | 17.689 | 15.478 | 21.19 | 19.843 | 14.979 | 17.96 | 84-64-0 | Technical |
| 13 | Butyl 2-ethylhexyl phthalate | — | 19.823 | 18.172 | 16.174 | 20.062 | 19.238 | 15.566 | 17.958 | 85-69-8 | Technical |
| 14 | Di-n-hexyl phthalate* | EPA 8061A | 22.138 | 20.279 | 17.984 | 22.152 | 21.469 | 17.215 | 19.829 | 84-75-3 | Neat |
| 15 | Butyl octyl phthalate | — | 22.338 | 20.557 | 18.136 | 22.37 | 21.668 | 17.344 | 20.009 | 84-78-6 | Technical |
| 16 | Butyl benzyl phthalate* | EPA 8061A, EPA Priority, EU | 22.799 | 20.783 | 18.029 | 25.365 | 23.782 | 17.384 | 21.128 | 85-68-7 | Neat |
| 17 | Hexyl 2-ethylhexyl phthalate | EPA 8061A | 24.404 | 22.668 | 20.266 | 24.110 | 23.500 | 19.126 | 22.049 | 75673-16-4 | Technical |
| 18 | Butyl isodecyl phthalate | — | 24.632 | 22.793 | 20.392 | 24.220 | 23.685 | 19.424 | 22.22 | 42343-36-2 | Technical |
| 19 | Bis(2-ethylhexyl)hexahydro phthalate | — | 25.066 | 23.389 | 21.254 | 23.089 | 23.063 | 19.142 | 21.961 | 84-71-9 | Neat |
| 20 | Bis(2-n-butoxyethyl) phthalate* | EPA 8061A | 25.601 | 23.563 | 20.930 | 26.746 | 25.647 | 19.849 | 23.533 | 117-83-9 | Neat |
| 21 | Dicyclohexyl phthalate* | EPA 8061A, EPA Priority, EU | 26.651 | 24.495 | 21.771 | 28.989 | 27.671 | 20.530 | 24.792 | 84-61-7 | Neat |
| 22 | Bis(2-ethylhexyl) phthalate* | EPA 8061A | 26.692 | 24.845 | 22.585 | 25.903 | 25.458 | 21.135 | 24.048 | 117-81-7 | Neat |
| 23 | Butyl-n-decyl phthalate | — | 27.362 | 25.268 | 22.657 | 26.888 | 26.410 | 21.404 | 24.471 | 89-19-0 | Technical |
| 24 | Diphenyl phthalate | — | 27.987 | 25.712 | 22.372 | 32.277 | 30.170 | 21.614 | 26.473 | 84-62-8 | Neat |
| 25 | Bis(4-methylcyclohexyl) phthalate isomer 1 | — | 28.003 | 25.922 | 23.016 | 29.547 | 28.476 | 21.677 | 25.923 | 59-43-8 | Isomer mix |
| 26 | Bis(4-methylcyclohexyl) phthalate isomer 2 | — | 29.002 | 26.993 | 23.816 | 30.345 | 29.400 | 22.604 | 26.739 | 59-43-8 | Isomer mix |
| 27 | Hexyl isodecyl phthalate | — | 29.176 | 27.271 | 24.523 | 28.189 | 27.965 | 23.224 | 26.336 | 61702-81-6 | Technical |
| 28 | Benzyl 2-ethylhexyl phthalate | — | 29.791 | 27.781 | 24.747 | 31.498 | 30.216 | 23.219 | 27.594 | 27215-22-1 | Technical |
| 29 | Bis(4-methylcyclohexyl) phthalate isomer-3 | — | 29.964 | 28.034 | 24.617 | 31.189 | 30.285 | 23.498 | 27.559 | 59-43-8 | Isomer mix |
| 30 | Bis(2-ethylhexyl) isophthalate | — | 30.132 | 28.037 | 25.684 | 28.133 | 28.243 | 23.907 | 26.648 | 137-89-3 | Neat |
| 31 | Bis(2-(ethoxyethoxy)ethyl) phthalate | — | 30.233 | 28.434 | 24.879 | 32.942 | 31.252 | 23.995 | 28.681 | 117-85-1 | Technical |
| 32 | Di-n-octyl phthalate* | EPA 8061A, EPA Priority, EU | 31.562 | 29.626 | 26.796 | 30.475 | 30.328 | 24.915 | 28.455 | 117-84-0 | Neat |
| 33 | n-Hexyl decyl phthalate | — | 31.680 | 29.748 | 26.878 | 30.788 | 30.450 | 24.994 | 28.566 | 25724-58-7 | Technical |
| 34 | Diphenyl isophthalate | — | 32.362 | 29.850 | N/A | 34.707 | 32.396 | 25.114 | 29.437 | 744-45-6 | Neat |
| 35 | Dibenzyl phthalate | — | 33.234 | 30.725 | 27.141 | 37.396 | 35.372 | 25.501 | 31.359 | 523-31-9 | Neat |
| 36 | Diisononyl phthalate | EU | 33.684 | 31.802 | 28.779 | 32.500 | 32.708 | 27.391 | 30.811 | 68515-48-0 | Isomer mix |
| 37 | Di-n-octyl isophthalate | — | 34.483 | 32.463 | 29.168 | 32.035 | N/A | 27.223 | 30.388 | 4654-18-6 | Neat |
| 38 | Diisodecyl phthalate | EU | 35.775 | 33.792 | 30.876 | 35.041 | N/A | 29.11 | 32.169 | 26761-40-0 | Isomer mix |
| 39 | Dinonyl phthalate* | EPA 8061A | 36.159 | 34.103 | 30.994 | 34.609 | 34.705 | 28.867 | 32.604 | 84-76-4 | Neat |
| 40 | n-Octyl-n-decyl phthalate | — | 36.182 | 34.170 | 30.961 | 34.664 | 34.7 | 28.861 | 32.628 | 119-07-3 | Technical |
Remarque : les zones grisées indiquent les coélutions (Rs<1,5).
*Ces composés se trouvent dans le mélange d’esters des phtalates 8061A de la méthode EPA Restek (réf. 33227).
Tableau III : Conditions analytiques GC-MS
| Parameters | Values for EPA EU List | Values for Extended List |
|---|---|---|
| Inlet temperature (°C) | 280 | 280 |
| Injection volume (µL) | 1.0 | 1.0 |
| Liner | Restek Premium 3.5 mm Precision liner w/ wool (cat.# 23320.1) | Restek Premium 3.5 mm Precision liner w/ wool (cat.# 23320.1) |
| Oven temperature program | 200 °C (hold 0.5 min) to 330 °C* at 30 °C/min (hold 1 min) |
150 °C (hold 0.8 min) to 200 °C at 5 °C/min to 275 °C at 3 °C/min (hold 2 min) |
| Carrier gas: He control mode | Constant linear velocity: 66.7 cm/sec @ 200 °C (3 mL/min**) |
Constant linear velocity: 48 cm/sec @ 150 °C (1.6 mL/min) |
| Split ratio | 20:1 | 20:1 |
| Detector | MS | MS |
| Mode: | Full Scan (59–400) | Full Scan (59–400) |
| Transfer line temp.: | 300 °C | 300 °C |
| Scan event time | 0.1 sec | 0.1 sec |
| Analyzer type: | Quadrupole | Quadrupole |
| Source temp.: | 280 °C | 280 °C |
| Solvent delay time: | 0.9 min | 2.5 min |
| Tune type: | PFTBA | PFTBA |
| Ionization mode: | EI | EI |
**320 °C pour la colonne Rtx-50
**3 ml/min peut être trop élevé pour certains appareils. Consultez le manuel d’utilisation de l’appareil.
Même si la GC-MS est la technique la plus couramment utilisée, l’analyse des phtalates peut également être réalisée par GC-ECD. La méthode EPA 8061A décrit l’identification et la quantification des phtalates dans des matrices aqueuses et solides avec deux colonnes montées en parallèle et deux détecteurs à capture d’électrons [8]. Les colonnes Rtx-440 et Rxi-35Sil MS répondent parfaitement aux exigences de cette méthode. Le logiciel Pro EZGC a permis d’établir des conditions opératoires pour une analyse rapide avec la colonne Rtx-440. La colonne Rxi-35Sil MS s’est avérée être une excellente colonne de confirmation étant donné les différences dans l’ordre d’élution observées. Les conditions analytiques en GC-ECD peuvent facilement être adaptées à partir des méthodes GC-MS décrites dans le Tableau III en utilisant le translateur de méthode en ligne gratuit Pro EZGC Restek. Les conditions d’analyse en GC-ECD optimisées et des exemples de chromatogrammes sont disponibles dans cet article du ChromaBLOGraphy [9].
Conclusion
Les performances des 7 colonnes GC les plus couramment utilisées pour l’analyse des phtalates ont été comparées en utilisant le programmePro EZGC, qui a grandement facilité l’optimisation des conditions d’analyse. La sélectivité et l’efficacité des colonnes Rtx-440 et Rxi-XLB ont garanti des temps d’analyse courts pour l’ensemble des phtalates étudiés. Considérant la bonne résolution globale, les températures maximales autorisées par leur excellente stabilité thermique (340 °C pour la colonne Rtx-440 et 360 °C pour la colonne Rxi-XLB [Tableau IV]), et leur très faible "bleeding", les colonnes Rtx-440 et Rxi-XLB s’imposent pour l’analyse GC-MS des phtalates. Les colonnes Rtx-440 et Rxi-35Sil MS utilisées en parallèle sont recommandées dans le cas d’analyse par GC-ECD.
Table IV : Températures maximales
| Rtx-440 (réf. 12923) |
Rxi-XLB (réf. 13723) |
Rxi-5ms (réf. 13423) |
Rtx-50 (réf. 10523) |
Rxi-35Sil MS (réf. 13823) |
Rtx-CLPesticides (réf. 11123) |
Rtx-CLPesticides2 (réf. 11323) |
|
|---|---|---|---|---|---|---|---|
| Maximum Temperature (°C) | 340 | 360 | 350 | 320 | 360 | 340 | 340 |
Remerciements
Les auteurs remercient la société Shimadzu Corporation pour son aide.
Références
- H. Choi, J. Kim, Y. Im, S. Lee, Y. Kim, The association between some endocrine disruptors and hypospadias in biological samples. J. Environ. Sci. Health, Part A: Toxic/Hazard. Subst. Environ. Eng. 47 (13) (2012) 2173–2179. http://www.ncbi.nlm.nih.gov/pubmed/22871016
- N. Nassar, P. Abeywardana, A. Barker, C. Bower, Parental occupational exposure to potential endocrine disrupting chemicals and risk of hypospadias in infants. Occup. Environ. Med. 67 (9) (2010) 585–589. http://www.ncbi.nlm.nih.gov/pubmed/19939854
- L. Trasande, S. Sathyanarayana, A.J. Spanier, H. Trachtman, T.M. Attina, E.M. Urbina, Urinary phthalates are associated with higher blood pressure in childhood. J. Pediatr. 163 (3) (2013) 747–753e1. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4074773/
- E.F. Werner, J.M. Braun, K. Yolton, J.C. Khoury, B.P. Lanphear, The association between maternal urinary phthalate concentrations and blood pressure in pregnancy: The HOME Study. Environ. Health 14 (2015) 75. http://www.ehjournal.net/content/14/1/75
- J.J. Jaakkola, T.L. Knight, The role of exposure to phthalates from polyvinyl chloride products in the development of asthma and allergies: A systematic review and meta-analysis. Environ. Health Perspect. 116 (7) (2008) 845–853. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2453150/
- E.E. Hatch, J.W. Nelson, R.W. Stahlhut, T.F. Webster, Association of endocrine disruptors and obesity: Perspectives from epidemiological studies. Int. J. Androl. 33 (2) (2010) 324–332. http://www.ncbi.nlm.nih.gov/pubmed/20113374
- S. Net, A. Delmont, R. Sempere, A. Paluselli, B. Ouddane, Reliable quantification of phthalates in environmental matrices (air, water, sludge, sediment and soil): A review. Sci. Total Environ. 515-516 (2015) 162–180. http://www.ncbi.nlm.nih.gov/pubmed/25723871
- U.S. Environmental Protection Agency, Method 8061A, Phthalate Esters by Gas Chromatography with Electron Capture Detection (GC/ECD), Rev. 1, December 1996. https://www.epa.gov/sites/production/files/2015-12/documents/8061a.pdf
- D. Li, Phthalate determination by dual column set in eight minutes, ChromaBLOGraphy, Restek Corporation, 2015.
Figure 1: EPA- and EU-listed phthalates and internal standard (benzyl benzoate) are shown under full scan mode and selected ion scan mode (m/z 293 and m/z 307) on seven different GC stationary phases (see Table III for conditions).
Rtx-440
| Peaks | |
|---|---|
| 1. | Dimethyl phthalate |
| 2. | Diethyl phthalate |
| 3. | Benzyl benzoate |
| 4. | Diisobutyl phthalate |
| 5. | Di-n-butyl phthalate |
| 6. | Bis(2-methoxyethyl) phthalate |
| 7. | Bis[4-methyl-2-pentyl] phthalate isomer 1 |
| 8. | Bis[4-methyl-2-pentyl] phthalate isomer 2 |
| 9. | Bis(2-ethoxyethyl) phthalate |
| 10. | Di-n-pentyl phthalate |
Rxi-XLB
Rtx-CLPesticides
Rtx-CLPesticides2
Figure 2: Target compounds on the extended phthalate list (50 µg/mL) are separated under full scan mode on an Rtx-440 column (see Table III for conditions).