GC-MS-Analyse von Phthalaten
Vergleich der Performance stationärer Phasen für die Gaschromatografie
Zusammenfassung
Phthalate sind in der Umwelt weit verbreitet und haben aufgrund ihrer potenziell schädlichen Auswirkungen für die menschliche Gesundheit Beachtung gefunden. Der Nachweis und die Trennung von Phthalaten ist deshalb zu einer Notwendigkeit geworden. Die Gaschromatografie ist eine effektive Methode zur Trennung von Phthalaten, die mit verschiedenen Detektionsverfahren wie Elektroneneinfang (ECD), Flammenionisation (FID) und Massenspektrometrie (MS) gekoppelt werden kann. In der vorliegenden Studie wurde die Methodenoptimierungssoftware Pro EZGC eingesetzt, um die optimalen stationären Phasen und Bedingungen für die GC-MS-Analyse von Phthalaten zu bestimmen. Die Trennung der Phthalate wurde auf sieben verschiedenen stationären Phasen verglichen: Rtx-440, Rxi-XLB, Rxi-5ms, Rtx-50, Rxi-35Sil MS, Rtx-CLPesticides und Rtx-CLPesticides2. In allen Fällen wurden 18 EPA- und EU-gelistete Phthalate in weniger als 6 Minuten analysiert. Zusätzlich wurde eine erweiterte Liste von 37 Phthalaten unter Verwendung einer optimierten Methode in weniger als 40 Minuten analysiert. Sowohl Rtx-440, eine nur von Restek erhältliche Phase, als auch Rxi-XLB Säulen zeigten die beste Auflösung des komplexen Phthalat-Gemisches.
Einführung
Phthalate werden in großem Umfang als Weichmacher in unterschiedlichen Industrieprodukten verwendet. Einige Phthalate gelten jedoch als endokrine Disruptoren [1] und werden mit einer Reihe von Problemen in Verbindung gebracht, darunter angeborene Fehlbildungen [2], Bluthochdruck bei Kindern [3], durch Bluthochdruck hervorgerufene Herzerkrankungen während der Schwangerschaft [4], Atemwegsstörungen [5] und Fettleibigkeit [6]. Die Europäische Union (EU) und die Umweltschutzbehörde der Vereinigten Staaten (U.S. EPA) haben die Verwendung der schädlichsten Phthalate eingeschränkt (Tabelle I).
GC-MS ist eine häufig verwendete Methode zur Analyse von Phthalaten, da sie einfach, schnell und kostengünstig ist. Die GC-MS-Methode liefert außerdem massenspektrometrische Informationen und bietet damit eine leistungsstarke Geräteplattform zur Identifikation der Phthalate. Die Verwendung einer GC-Säule mit guter Trennleistung ist wichtig, weil die massenspektrometrische Identifikation und die quantitative Bestimmung aufgrund der strukturellen Ähnlichkeiten der Phthalate schwierig sein kann. So ist vielen Phthalaten ein Basispeak-Ion (m/z 149) gemeinsam, was die Identifikation und Quantifizierung von koeluierenden Phthalaten erschwert. Gemische technischer Qualität und Isomere machen das Problem noch komplizierter.
Eine kürzlich veröffentlichte Abhandlung gibt einen Überblick über die am häufigsten verwendeten GC- und LC-Säulen für die Phthalat-Analyse [7]. Gemäß der vorliegenden Literatur bietet die GC-MS eine bessere Auflösung für die Phthalat-Analytik als die LC-MS. Die am häufigsten verwendeten GC-Säulen in absteigender Reihenfolge ihrer Beliebtheit sind 5er, XLB-, 35er, 17er, 50er und 1er Phasen. Die auf einer stationären Phase erzielte Trennung lässt sich durch Anpassung der Gerätebedingungen verbessern, aber das kann im Labor ein zeitaufwändiges Verfahren sein. Mithilfe der Methodenoptimierungssoftware Pro EZGC lassen sich die GC-Parameter (z. B. Trägergastyp, Flussrate, Temperaturprogramm, Säulenabmessungen und Vorsäule) schnell optimieren, um die kürzest mögliche Analysezeit für eine gegebene stationäre Phase zu realisieren. In dieser Untersuchung wurden für 37 Phthalate (Tabelle II) Bibliotheken für die folgenden sieben stationären Phasen für das Pro EZGC-Programm erstellt: Rtx-440, Rxi-XLB, Rxi-5ms, Rtx-50, Rxi-35Sil MS, Rtx-CLPesticides und Rtx-CLPesticides2. Diese stationären Phasen wurden zur Analyse von sowohl regulierten als auch unregulierten Phthalaten ausgewertet.
Verwendete Chemikalien
Das Phthalatester-Gemisch für EPA-Methode 8061A von Restek (Art.-Nr. 33227), Das Phthalatester-Gemisch für EPA-Methode 8061A von Restek (Art.-Nr. 33227), das 15 der gewünschten Analyten in einer Konzentration von jeweils 1000 μg/mL enthält, wurde als primärer Referenzstandard verwendet. Als interner Standard wurde Benzylbenzoat (Art.-Nr. 31847) verwendet. Alle anderen Phthalat-Standards wurden von Chem Service bezogen.
Gerät
Die GC-MS-Analytik wurde auf einem Shimadzu QP2010 Plus GC-MS durchgeführt. Das Gerät war mit einer der sieben Restek-Säulen (je 30 m x 0.25 mm x 0.25 µm bzw. 0.20 µm für die Säule Rtx-CLPesticides2) bestückt. Die Windows-basierte Software Pro EZGC wurde verwendet, um die optimalen Bedingungen für jede Säule festzulegen. Anschließend wurden alle Säulen direkt miteinander verglichen, indem die Proben einheitlich unter genau den Bedingungen analysiert wurden, die die insgesamt beste Trennleistung ergeben hatten. Dieser direkte Vergleich liefert ein besseres Verständnis der Selektivitätsunterschiede zwischen den einzelnen Säulen. Detaillierte Säulenbeschreibungen und die experimentellen GC-MS-Parameter sind in den Tabellen I und III angegeben.
Probenvorbereitung
Die Standards wurden in Methylenchlorid gelöst und verdünnt. Standardlösungen wurden hergestellt mit 50 μg/mL (bzw. 80 μg/mL für den internen Standard Benzylbenzoat). Während der Probenvorbereitung wurde die Verwendung von Plastikteilen sorgsam vermieden; alle Vorbereitungsarbeiten wurden mithilfe von Glasgeräten (Messkolben, Spritzen, Fläschchen usw.) durchgeführt.
Ergebnisse und Diskussion
Für Phthalate, die von der EPA und der EU reguliert werden, wurde ein direkter Vergleich der Säulentrennleistung durchgeführt. Retentionszeiten für Phthalate auf sieben verschiedenen Phasen wurden vom Pro EZGC-Programm unter identischen GC-Bedingungen vorhergesagt. Die in Tabelle I gezeigten Bedingungen lieferten die insgesamt besten chromatografischen Ergebnisse von allen Setups, die für die einzelnen Säulen optimiert worden waren. Als koeluierend wurden Substanzpaare mit einer Auflösung von weniger als 1.5 definiert. Die Gesamtanalysezeit betrug weniger als 6 Minuten. Zur Bestätigung der durch die Pro EZGC-Software vorhergesagten Retentionszeiten wurden Chromatogramme für jede stationäre Phase unter den gleichen Bedingungen wie bei der Software aufgenommen (Abbildung 1). Da die Säulenlängen im Gegensatz zur Simulation nicht exakt 30 m betrugen, zeigten die absoluten Retentionszeiten geringfügige Abweichungen von den vorhergesagten Werten; die Elutionsreihenfolge und die koeluierenden Substanzpaare stimmten jedoch exakt mit den Vorhersagen überein. Die Säulen Rtx-440, Rxi-XLB, Rtx-CLPesticides und Rxi-35Sil MS erreichten Basislinientrennungen für alle EPA- und EU-gelisteten Phthalate. Die beiden Isomere des Bis[4-methyl-2-pentyl] phthalats ließen sich auf keiner der sieben Phasen trennen. Die Elutionsreihenfolge auf den Säulen Rtx-440, Rxi-XLB, Rtx-CLPesticides und Rxi-5ms war vergleichbar.
.
Tabelle I: Vorhergesagte Elutionszeiten für regulierte Phthalate auf verschiedenen GC-Säulen von Restek
Säule: 30 m x 0.25 mm x 0.25 μm (0.20 μm für die Rtx-CLPesticides2-Säule)
Konstante Lineargeschwindigkeit: 66.7 cm/sec
Ofen: 200 °C (0.5 min), auf 330 °C (320 °C für Rtx-50) mit 30 °C/min (1 min)
| Peak Nr. | Bezeichnung | Gelistet in | Retentionszeit (min) | CAS Nr. | Reinheit | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Rtx-440 (Art.-Nr. 12923) |
Rxi-XLB (Art.-Nr. 13723) |
Rtx- CLPesticides (Art.-Nr. 11123) |
Rxi-35Sil MS (Art.-Nr. 13823) | Rtx-50 (Art.-Nr. 10523) |
Rxi-5ms (Art.-Nr. 13423) |
Rtx- CLPesticides2 (Art.-Nr. 11323) |
|||||
| 1 | Dimethylphthalat* | EPA 8061A, EPA Priority | 1.28 | 1.16 | 1.14 | 1.29 | 1.46 | 1.10 | 1.23 | 131-11-3 | Rein |
| 2 | Diethylphthalat* | EPA 8061A, EPA Priority, EU | 1.54 | 1.39 | 1.33 | 1.55 | 1.73 | 1.30 | 1.47 | 84-66-2 | Rein |
| 3 | Benzylbenzoat | Internal Standard | 2.11 | 1.87 | 1.56 | 2.17 | 2.31 | 1.70 | 1.88 | 120-51-4 | Rein |
| 4 | Diisobutylphthalat* | EPA 8061A | 2.25 | 2.04 | 1.88 | 2.21 | 2.34 | 1.91 | 2.10 | 84-69-5 | Rein |
| 5 | Di-n-butylphthalat* | EPA 8061A, EPA Priority | 2.58 | 2.33 | 2.10 | 2.53 | 2.69 | 2.17 | 2.38 | 84-74-2 | Rein |
| 6 | Bis(2-methoxyethyl)phthalat* | EPA 8061A | 2.74 | 2.48 | 2.26 | 2.86 | 3.10 | 2.27 | 2.63 | 117-82-8 | Rein |
| 7 | Bis(4-methyl-2-pentyl)phthalat-Isomer 1* | EPA 8061A | 2.85 | 2.62 | 2.37 | 2.71 | 2.83 | 2.50 | 2.64 | 84-63-9 | Rein |
| 8 | Bis(4-methyl-2-pentyl)phthalat-Isomer 2* | EPA 8061A | 2.86 | 2.63 | 2.37 | 2.72 | 2.84 | 2.51 | 2.65 | 84-63-9 | Rein |
| 9 | Bis(2-methoxyethyl)phthalat* | EPA 8061A | 3.08 | 2.80 | 2.51 | 3.13 | 3.33 | 2.59 | 2.90 | 605-54-9 | Rein |
| 10 | Di-n-pentylphthalat* | EPA 8061A | 3.16 | 2.91 | 2.58 | 3.08 | 3.21 | 2.71 | 2.89 | 131-18-0 | Rein |
| 11 | Di-n-hexylphthalat* | EPA 8061A | 3.73 | 3.46 | 3.07 | 3.61 | 3.69 | 3.25 | 3.42 | 84-75-3 | Rein |
| 12 | Butylbenzylphthalat* | EPA 8061A, EPA Priority, EU | 3.85 | 3.56 | 3.12 | 3.93 | 4.13 | 3.30 | 3.63 | 85-68-7 | Rein |
| 13 | Hexyl-2-ethylhexylphthalat | EPA 8061A | 3.98 | 3.72 | 3.29 | 3.83 | 3.92 | 3.52 | 3.66 | 75673-16-4 | Technische Qualität |
| 14 | Bis(2-butoxyethyl)phthalat* | EPA 8061A | 4.12 | 3.82 | 3.39 | 4.08 | 4.21 | 3.60 | 3.85 | 117-83-9 | Rein |
| 15 | Bis(2-ethylhexyl)phthalat* | EPA 8061A | 4.21 | 3.95 | 3.52 | 4.05 | 4.12 | 3.82 | 3.91 | 117-81-7 | Rein |
| 16 | Dicyclohexylphthalat* | EPA 8061A, EPA Priority, EU | 4.33 | 4.04 | 3.55 | 4.42 | 4.58 | 3.78 | 4.08 | 84-61-7 | Rein |
| 17 | Di-n-octylphthalat* | EPA 8061A, EPA Priority, EU | 4.76 | 4.50 | 3.97 | 4.59 | 4.62 | 4.24 | 4.39 | 117-84-0 | Rein |
| 18 | Diisononylphthalat | EU | 5.10 | 4.84 | 4.23 | 4.84 | 4.84 | 4.50 | 4.64 | 68515-48-0 | Isomerengemisch |
| 19 | Diisodecylphthalat | EU | 5.20 | 4.95** | 4.42 | 5.01 | 5.18 | 4.71 | 4.90 | 26761-40-0 | Isomerengemisch |
| 20 | Dinonylphthalat* | EPA 8061A | 5.24 | 4.95** | 4.39 | 5.04 | 5.10 | 4.72 | 4.83 | 84-76-4 | Rein |
Hinweis: Die Schattierung zeigt koeluierende Peaks an (Rs<1.5). Für die einzelnen Säulen zeigen unterschiedliche Schattierungsfarben unterschiedliche Koelutionspaare an..
*Diese Verbindungen sind im Phthalatester-Gemisch von Restek für die EPA- Methode 8061A enthalten (Art.-Nr. 33227).
**Peaks 19 und 20 sind nicht isobar und können durch Selected Ion Monitoring (SIM) getrennt werden.
Auf den Phasen Rxi-35Sil MS und Rtx-50 wurden Unterschiede in der Elutionsreihenfolge beobachtet. Insbesondere änderte sich die Elutionsreihenfolge von vier Paaren von Phthalaten auf der Phase Rxi-35Sil MS, darunter die Isomere Bis(2-methoxyethyl)phthalat/Bis(4-methyl-2-pentyl)phthalat (Peaks 6 und 7/8), Bis(2-ethoxyethyl)phthalat/Di-n-pentylphthalat (Peaks 9 und 10), Butylbenzylphthalat/Hexyl-2-ethylhexylphthalat (Peaks 12 und 13) und Bis(2-butoxyethyl)phthalat/Bis(2-ethylhexyl)phthalat (Peaks 14 und 15).
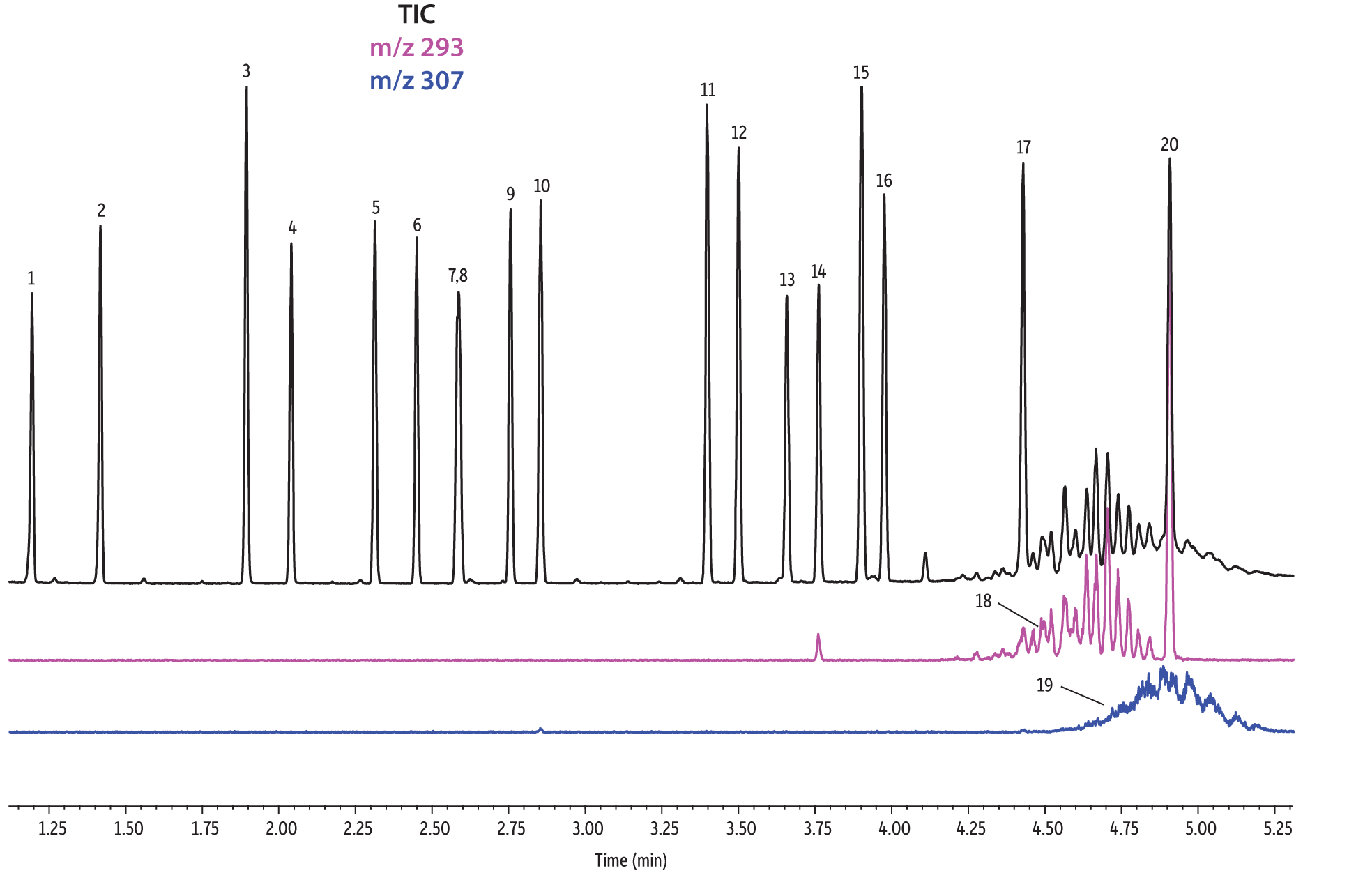
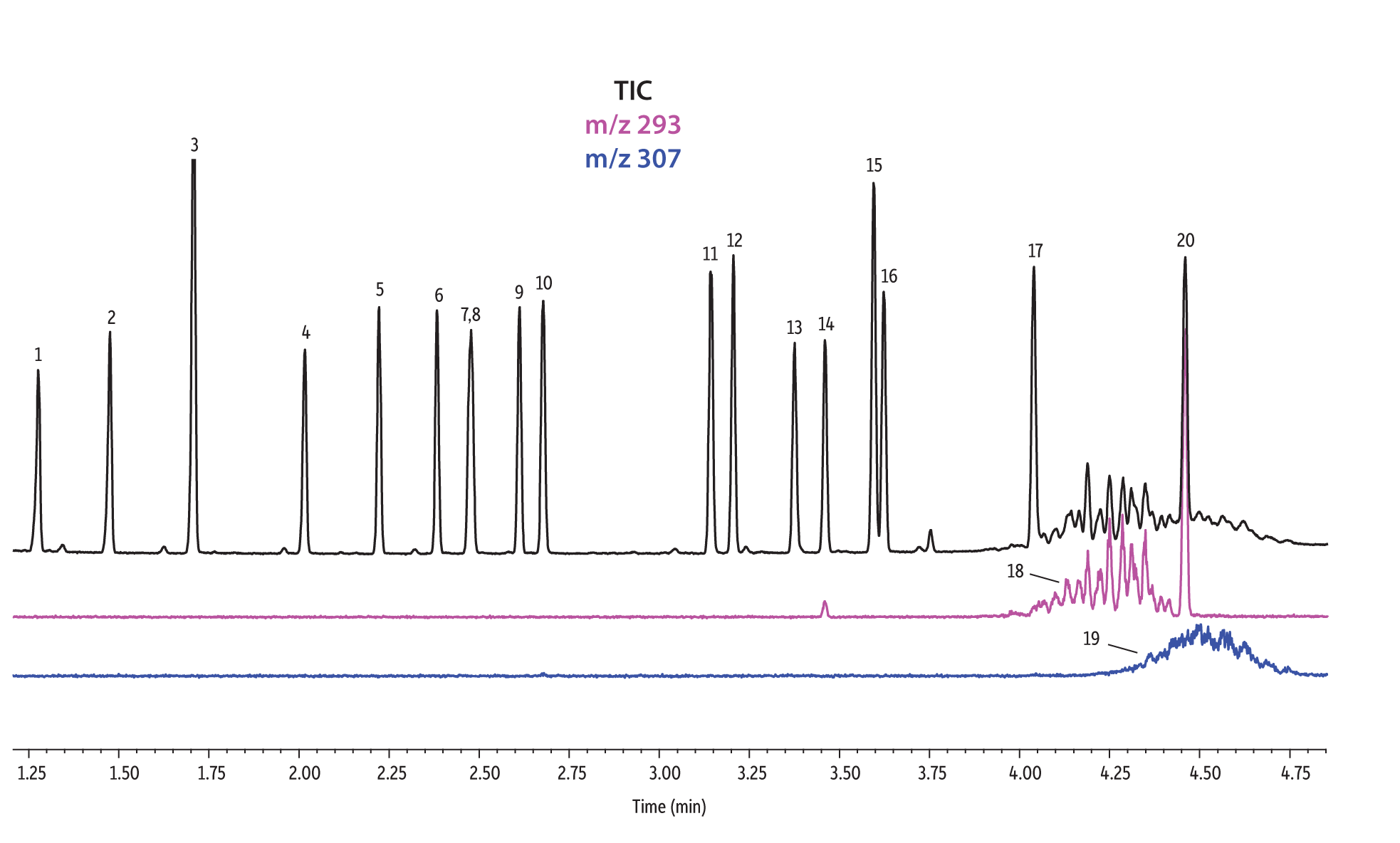
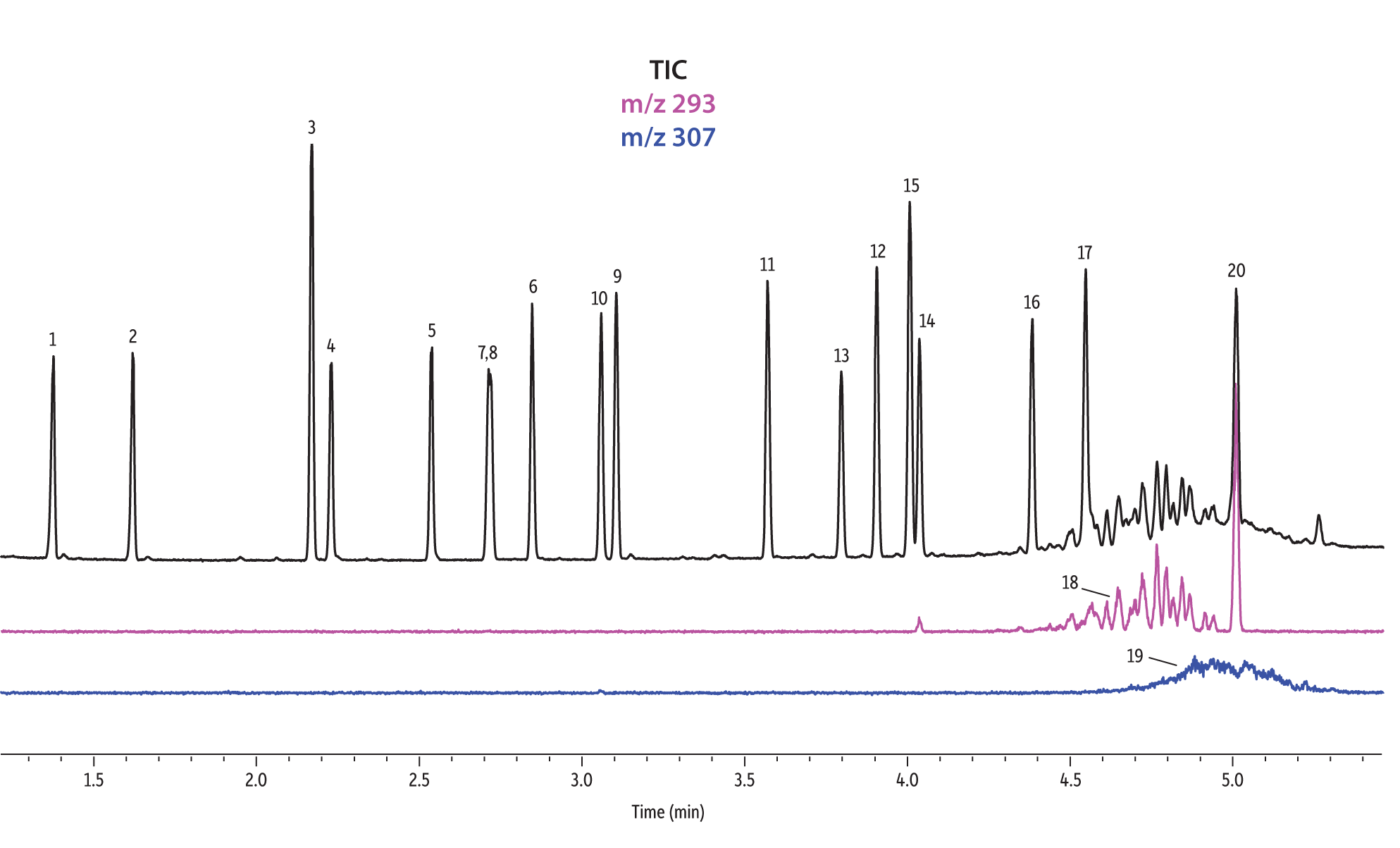
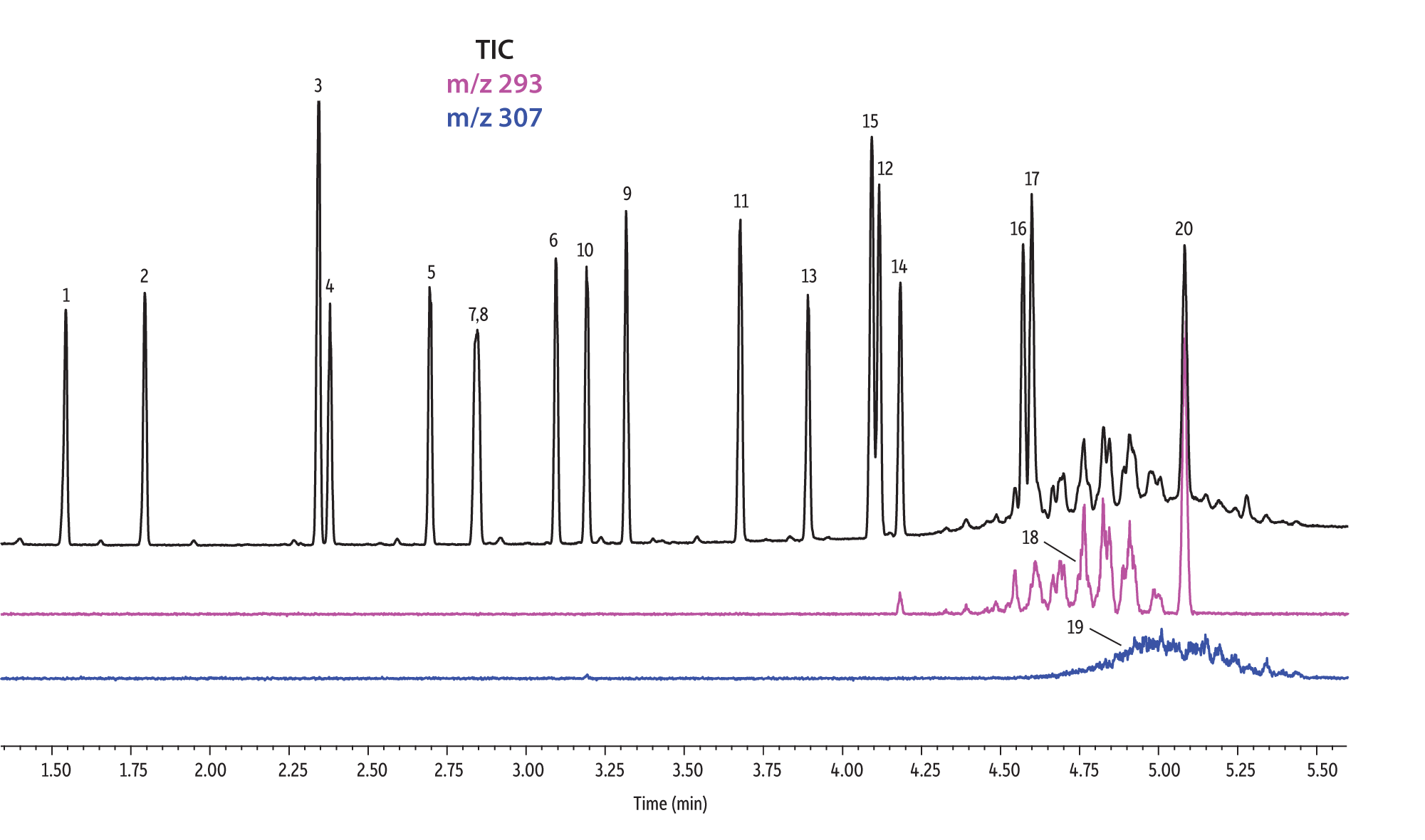
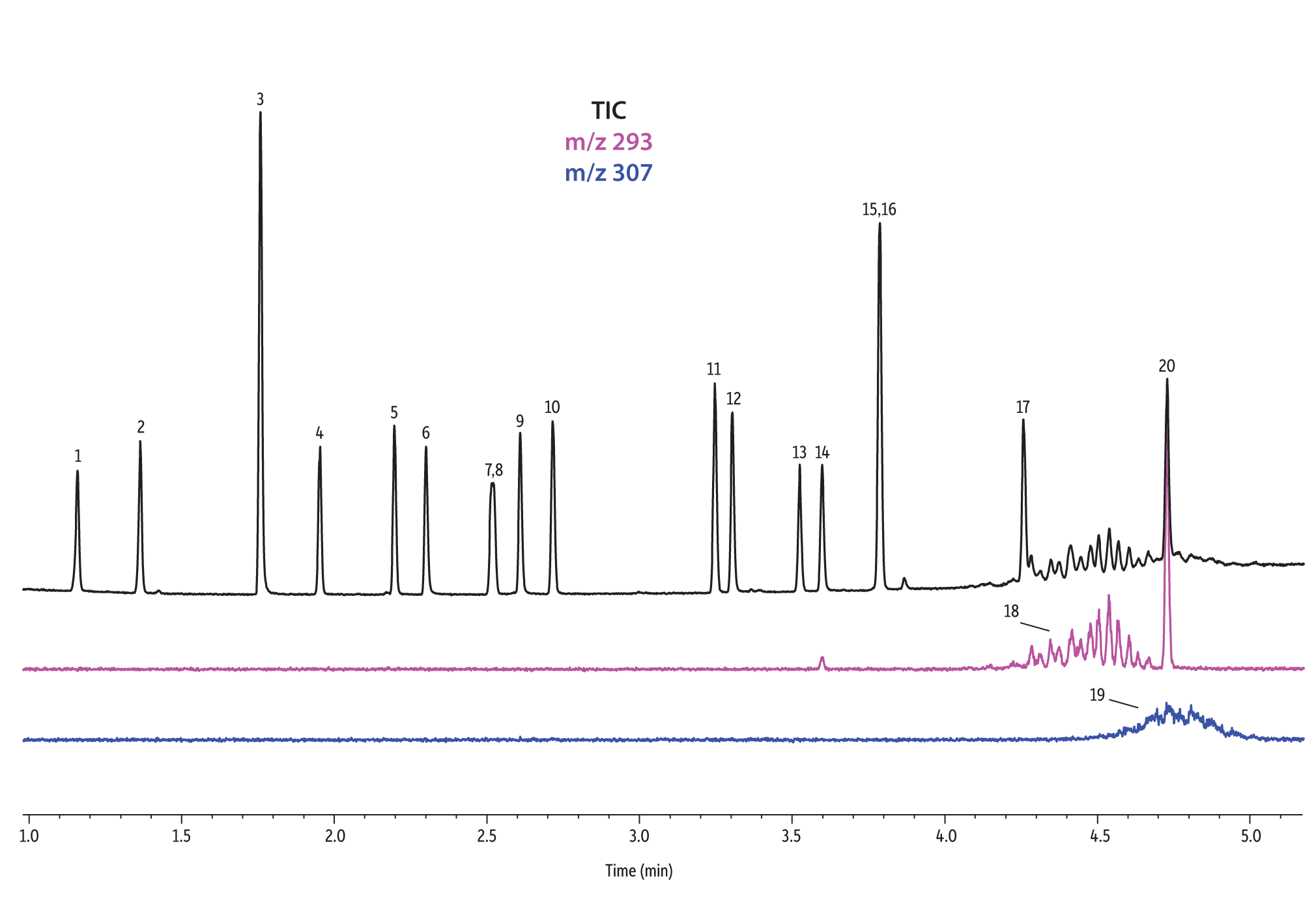
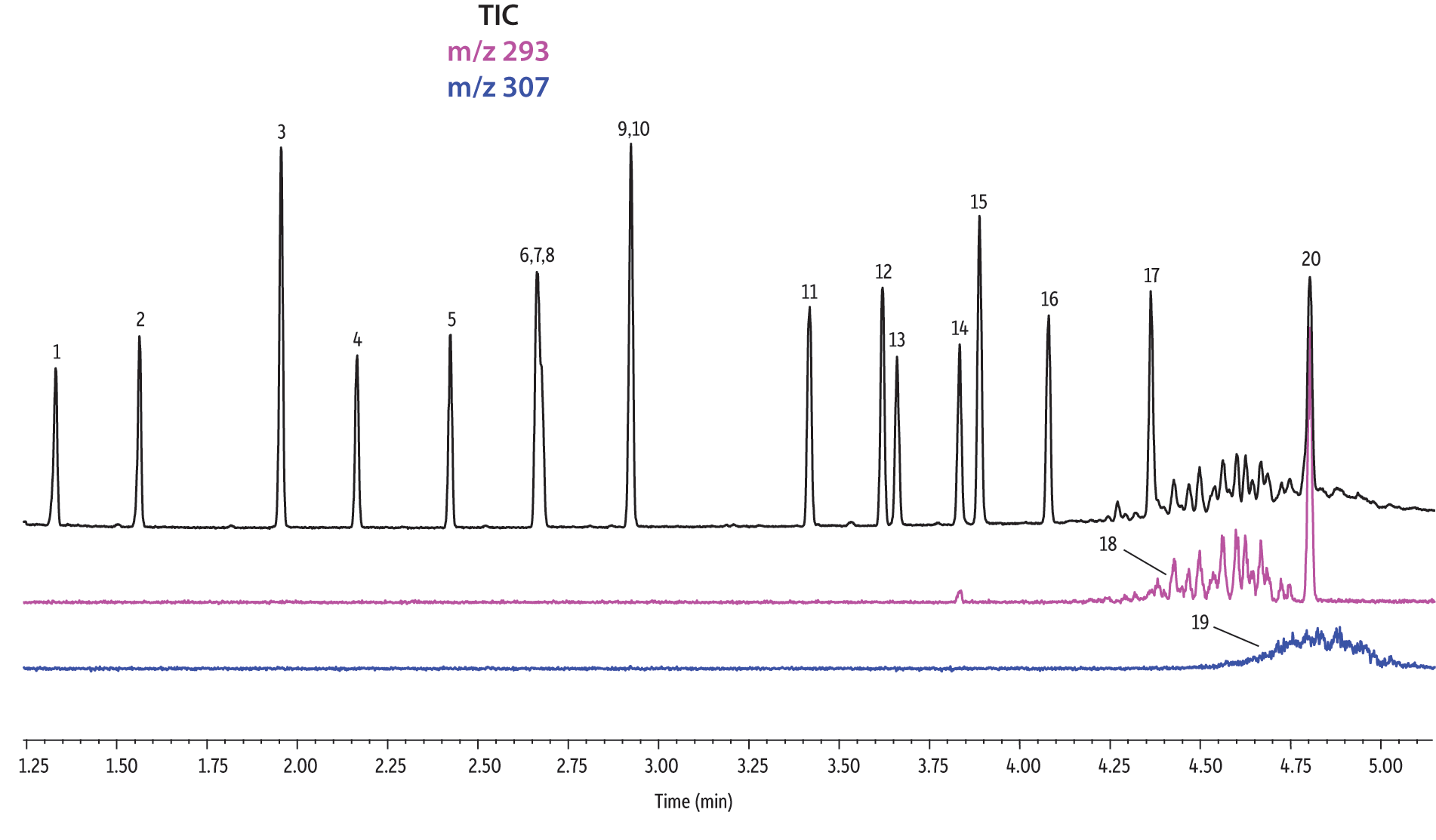
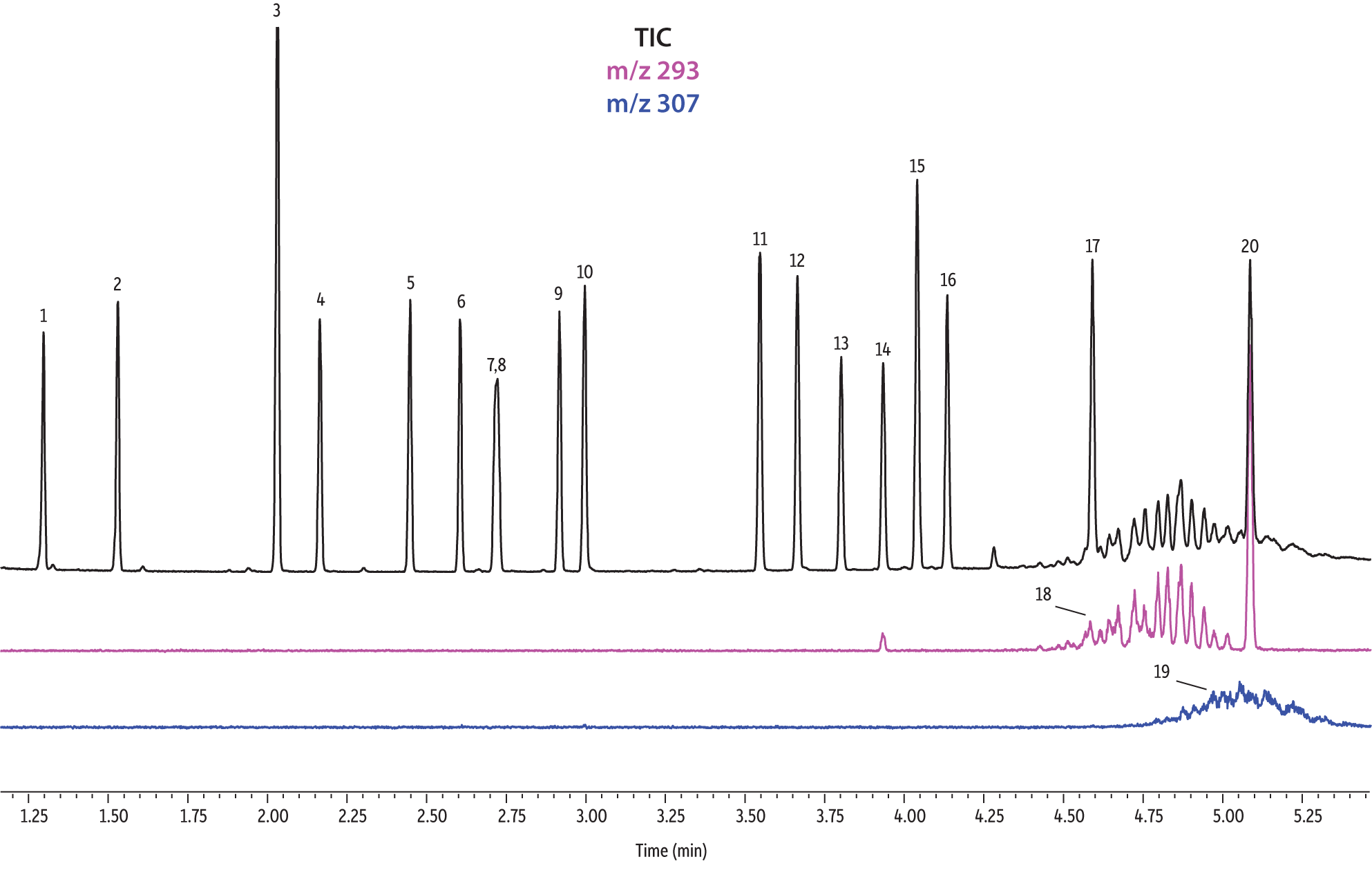
Die Säulen mit den Phasen Rtx-440 und Rxi-XLB zeigten die insgesamt beste Trennleistung unter diesen Bedingungen. Peaks, die auf anderen Phasen koeluierten, wurden auf Rtx-440- und Rxi-XLB-Säulen gut aufgelöst. Zu den Paaren, die auf anderen Phasen nicht aufgelöst wurden, gehören Bis(2-ethylhexyl)phthalat und Dicyclohexylphthalat (Peaks 15 und 16) auf der Rxi-5ms-Säule, Bis(2-ethylhexyl)phthalat und Butylbenzylphthalat (Peaks 15 und 12) auf der Rtx-50-Säule und Bis(2-methoxyethyl) und Bis[4-methyl-2-pentyl]phthalat (Peaks 6 und 7,8) sowie Bis(2-ethoxyethyl)phthalat und Di-n-pentylphthalat (Peaks 9 und 10) auf der Rtx-CLPesticides2-Säule. In Isomerengemischen technischer Qualität können Isomerengruppen wie Diisononylphthalat und Diisodecylphthalat (Peaks 18 und 19) identifiziert werden, aber es ist nicht möglich, jedes einzelne Isomer innerhalb einer Gruppe vollständig aufzulösen. Zum Glück gibt es eindeutige Ionen zur Identifikation und zur quantitativen Bestimmung, z. B. m/z 293 für Diisononylphthalat und m/z 307 für Diisododecylphthalat (Abbildung 1).
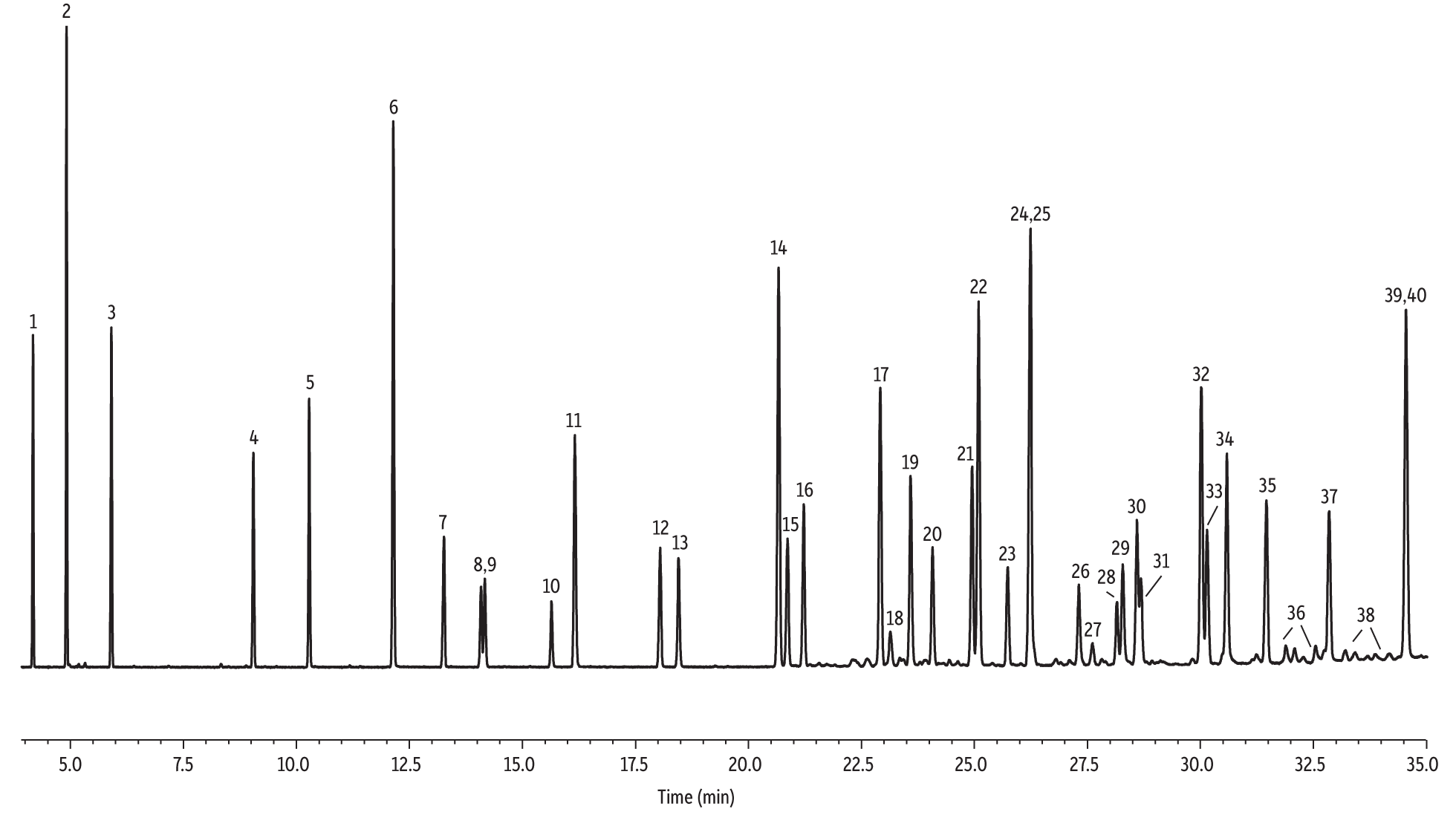
Ein umfassenderer Vergleich der sieben stationären Phasen wurde für die Trennung von 37 Phthalaten (insgesamt 40 Peaks, einschließlich dreier Isomere) anhand der von der Pro EZGC-Software vorhergesagten Retentionszeiten durchgeführt (Tabelle II). Die in Tabelle III angegebenen GC-Parameter ermöglichten die Trennung von 34 der 40 Peaks auf sowohl den Rtx-440- als auch den Rxi-XLB-Säulen in weniger als 40 Minuten und die beiden Phasen führten zu unterschiedlichen Koelutionen. Das Chromatogramm der Rtx-440-Säule wurde erfasst und ist in Abbildung 2 dargestellt. Für einige Paare, die nicht basisliniengetrennt werden konnten, war die Auflösung dennoch ausreichend für eine qualitative Analyse. Es gibt keinen einzigen Satz von Bedingungen, der für alle Phasen optimal ist. Das Programm mit den insgesamt besten Ergebnissen in puncto Geschwindigkeit und Zahl der aufgelösten Peaks wurde für den direkten Säulenvergleich ausgewählt. Analytiker können die Bedingungen für ihre spezifischen Substanzlisten unter Verwendung des Pro EZGC-Programms optimieren. Aufgrund der Analysegeschwindigkeit insgesamt und der hohen Trennschärfe für die Zielanalyten empfehlen wir die Verwendung der Phasen Rtx-440 und Rxi-XLB zur GC-MS-Analyse von Phthalaten.
Tabelle II: Vorhergesagte Elutionszeiten für Phthalate (erweiterte Liste) auf verschiedenen GC-Säulen von Restek
Säule: 30 m x 0.25 mm x 0.25 μm (0.20 μm für die Rtx-CLPesticides2-Säule)
Konstante Lineargeschwindigkeit: 48 cm/sec
Ofen: 150 °C (0.8 min), auf 200 °C mit 5 °C/min, auf 275 °C mit 3 °C/min (2 min)
| Peak-Nr. | Bezeichnung | Gelistet in | Retentionszeit (min) | CAS Nr. | Reinheit | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Rtx-440 (Art.-Nr. 12923) |
Rxi-XLB (Art.-Nr. 13723) |
Rxi-5ms (Art.-Nr. 13423) | Rtx-50 (Art.-Nr. 10523) | Rxi-35Sil MS (Art.-Nr. 13823) | Rtx- CLPesticides (Art.-Nr. 11123) |
Rtx- CLPesticides2 (Art.-Nr. 11323) |
|||||
| 1 | Dimethylphthalat* | EPA 8061A, EPA Priority | 4.606 | 3.924 | 3.294 | 5.912 | 4.902 | 3.75 | 4.334 | 131-11-3 | Rein |
| 2 | Dimethylisophthalat | — | 5.491 | 4.690 | 3.85 | 6.35 | 5.498 | 4.174 | 4.793 | 1459-93-4 | Rein |
| 3 | Diethylphthalat* | EPA 8061A, EPA Priority, EU | 6.537 | 5.642 | 4.762 | 7.809 | 6.785 | 5.24 | 6.106 | 84-66-2 | Rein |
| 4 | Benzylbenzoat | Internal Standard | 9.931 | 8.667 | N/A | 11.099 | N/A | 6.725 | 8.583 | 120-51-4 | Rein |
| 5 | Diisobutylphthalat* | EPA 8061A | 11.185 | 10.029 | 8.817 | 11.817 | 11.008 | 9.101 | 10.333 | 84-69-5 | Rein |
| 6 | Di-n-butylphthalat* | EPA 8061A, EPA Priority | 13.152 | 11.850 | 10.405 | 14.031 | 13.094 | 10.481 | 12.029 | 84-74-2 | Rein |
| 7 | Bis(2-methoxyethyl)phthalat* | EPA 8061A | 14.343 | 12.784 | 11.045 | 17.095 | 15.424 | 11.54 | 13.725 | 117-82-8 | Rein |
| 8 | Bis(4-methyl-2-pentyl)phthalat-Isomer 1* | EPA 8061A | 15.192 | 13.754 | 12.47 | 15.184 | 14.454 | 12.166 | 13.825 | 84-63-9 | Rein |
| 9 | Bis(4-methyl-2-pentyl)phthalat-Isomer-2* | EPA 8061A | 15.350 | 13.828 | 12.55 | 15.277 | 14.542 | 12.233 | 13.906 | 84-63-9 | Rein |
| 10 | Bis(2-ethoxyethyl)phthalat* | EPA 8061A | 16.910 | 15.132 | 13.199 | 19.063 | 17.59 | 13.186 | 15.875 | 605-54-9 | Rein |
| 11 | Di-n-pentylphthalat* | EPA 8061A | 17.454 | 15.880 | 13.856 | 17.974 | 17.128 | 13.588 | 15.768 | 131-18-0 | Rein |
| 12 | Butylcyclohexylphthalat | — | 19.452 | 17.689 | 15.478 | 21.19 | 19.843 | 14.979 | 17.96 | 84-64-0 | Technische Qualität |
| 13 | Butyl-2-ethylhexylphthalat | — | 19.823 | 18.172 | 16.174 | 20.062 | 19.238 | 15.566 | 17.958 | 85-69-8 | Technische Qualität |
| 14 | Di-n-hexylphthalat* | EPA 8061A | 22.138 | 20.279 | 17.984 | 22.152 | 21.469 | 17.215 | 19.829 | 84-75-3 | Rein |
| 15 | Butyloctylphthalat | — | 22.338 | 20.557 | 18.136 | 22.37 | 21.668 | 17.344 | 20.009 | 84-78-6 | Technische Qualität |
| 16 | Butylbenzylphthalat* | EPA 8061A, EPA Priority, EU | 22.799 | 20.783 | 18.029 | 25.365 | 23.782 | 17.384 | 21.128 | 85-68-7 | Rein |
| 17 | Hexyl-2-ethylhexylphthalat | EPA 8061A | 24.404 | 22.668 | 20.266 | 24.110 | 23.500 | 19.126 | 22.049 | 75673-16-4 | Technische Qualität |
| 18 | Butylisodecylphthalat | — | 24.632 | 22.793 | 20.392 | 24.220 | 23.685 | 19.424 | 22.22 | 42343-36-2 | Technische Qualität |
| 19 | Bis(2-ethylhexyl)hexahydrophthalat | — | 25.066 | 23.389 | 21.254 | 23.089 | 23.063 | 19.142 | 21.961 | 84-71-9 | Rein |
| 20 | Bis(2-n-butoxyethyl)phthalat* | EPA 8061A | 25.601 | 23.563 | 20.930 | 26.746 | 25.647 | 19.849 | 23.533 | 117-83-9 | Rein |
| 21 | Dicyclohexylphthalat* | EPA 8061A, EPA Priority, EU | 26.651 | 24.495 | 21.771 | 28.989 | 27.671 | 20.530 | 24.792 | 84-61-7 | Rein |
| 22 | Bis(2-ethylhexyl)phthalat* | EPA 8061A | 26.692 | 24.845 | 22.585 | 25.903 | 25.458 | 21.135 | 24.048 | 117-81-7 | Rein |
| 23 | Butyl-n-decylphthalat | — | 27.362 | 25.268 | 22.657 | 26.888 | 26.410 | 21.404 | 24.471 | 89-19-0 | Technische Qualität |
| 24 | Diphenylphthalat | — | 27.987 | 25.712 | 22.372 | 32.277 | 30.170 | 21.614 | 26.473 | 84-62-8 | Rein |
| 25 | Bis(4-methylcyclohexyl)phthalat-Isomer 1 | — | 28.003 | 25.922 | 23.016 | 29.547 | 28.476 | 21.677 | 25.923 | 59-43-8 | Isomerengemisch |
| 26 | Bis(4-methylcyclohexyl)phthalat-Isomer 2 | — | 29.002 | 26.993 | 23.816 | 30.345 | 29.400 | 22.604 | 26.739 | 59-43-8 | Isomerengemisch |
| 27 | Hexylisodecylphthalat | — | 29.176 | 27.271 | 24.523 | 28.189 | 27.965 | 23.224 | 26.336 | 61702-81-6 | Technische Qualität |
| 28 | Benzyl-2-ethylhexylphthalat | — | 29.791 | 27.781 | 24.747 | 31.498 | 30.216 | 23.219 | 27.594 | 27215-22-1 | Technische Qualität |
| 29 | Bis(4-methylcyclohexyl)phthalat-Isomer-3 | — | 29.964 | 28.034 | 24.617 | 31.189 | 30.285 | 23.498 | 27.559 | 59-43-8 | Isomerengemisch |
| 30 | Bis(2-ethylhexyl)isophthalat | — | 30.132 | 28.037 | 25.684 | 28.133 | 28.243 | 23.907 | 26.648 | 137-89-3 | Rein |
| 31 | Bis(2-(ethoxyethoxy)ethyl)phthalat | — | 30.233 | 28.434 | 24.879 | 32.942 | 31.252 | 23.995 | 28.681 | 117-85-1 | Technische Qualität |
| 32 | Di-n-octylphthalat* | EPA 8061A, EPA Priority, EU | 31.562 | 29.626 | 26.796 | 30.475 | 30.328 | 24.915 | 28.455 | 117-84-0 | Rein |
| 33 | n-Hexyldecylphthalat | — | 31.680 | 29.748 | 26.878 | 30.788 | 30.450 | 24.994 | 28.566 | 25724-58-7 | Technische Qualität |
| 34 | Diphenylisophthalat | — | 32.362 | 29.850 | N/A | 34.707 | 32.396 | 25.114 | 29.437 | 744-45-6 | Rein |
| 35 | Dibenzylphthalat | — | 33.234 | 30.725 | 27.141 | 37.396 | 35.372 | 25.501 | 31.359 | 523-31-9 | Rein |
| 36 | Diisononylphthalat | EU | 33.684 | 31.802 | 28.779 | 32.500 | 32.708 | 27.391 | 30.811 | 68515-48-0 | Isomerengemisch |
| 37 | Di-n-octylisophthalat | — | 34.483 | 32.463 | 29.168 | 32.035 | N/A | 27.223 | 30.388 | 4654-18-6 | Rein |
| 38 | Diisodecylphthalat | EU | 35.775 | 33.792 | 30.876 | 35.041 | N/A | 29.11 | 32.169 | 26761-40-0 | Isomerengemisch |
| 39 | Dinonylphthalat* | EPA 8061A | 36.159 | 34.103 | 30.994 | 34.609 | 34.705 | 28.867 | 32.604 | 84-76-4 | Rein |
| 40 | n-Octyl-n-decylphthalat | — | 36.182 | 34.170 | 30.961 | 34.664 | 34.7 | 28.861 | 32.628 | 119-07-3 | Technische Qualität |
Hinweis: Die Schattierung zeigt koeluierende Peaks an (Rs<1.5). Für die einzelnen Säulen zeigen unterschiedliche Schattierungsfarben unterschiedliche Koelutionspaare an.
*Diese Verbindungen sind im Phthalatester-Gemisch von Restek für die EPA- Methode 8061A enthalten (Art.-Nr. 33227).
Tabelle III: GC-MS Parameter
| Parameter | Werte für EPA & EU-Listen | Werte für erweiterte Liste |
|---|---|---|
| Injektortemperatur (°C) | 280 | 280 |
| Injektionsvolumen (µL) | 1.0 | 1.0 |
| Liner | Restek Premium 3.5mm Precision Liner mit Glaswolle (Art.-Nr. 23320.1) | Restek Premium 3.5mm Precision Liner mit Glaswolle (Art.-Nr. 23320.1) |
| Ofen Temperaturprogramm | 200 °C (0.5 min) auf 330 °C* mit 30 °C/min (1 min) |
150 °C (0.8 min), auf 200 °C mit 5 °C/min, auf 275 °C mit 3 °C/min (2 min) |
| Trägergas: He | Konstante Lineargeschwindigkeit: 66.7 cm/sec bei 200 °C (3 mL/min**) |
Konstante Lineargeschwindigkeit: 48 cm/sec bei 150 °C (1.6 mL/min) |
| Split-Verhältnis | 20:1 | 20:1 |
| Detektor | MS | MS |
| Modus: | Vollscan (59–400) | Vollscan (59–400) |
| Temp. Transferline: | 300 °C | 300 °C |
| Scanereigniszeit | 0.1 sec | 0.1 sec |
| Analysatortyp: | Quadrupol | Quadrupol |
| Ionenquellentemperatur: | 280 °C | 280 °C |
| Lösemittelausblendung: | 0.9 min | 2.5 min |
| Tuning-Typ: | PFTBA | PFTBA |
| Ionisierungsmodus: | EI | EI |
*320 °C für Rtx-50
**3 mL/min ist für manche Geräte möglicherweise zu hoch. Konsultieren Sie das Betriebshandbuch Ihres Geräts vor der Programmierung.
Obwohl GC-MS im allgemeinen die bevorzugte Methode ist, da sie eindeutigere Informationen liefert, lassen sich Phthalate auch mithilfe von GC-ECD erfolgreich analysieren. EPA 8061A ist eine Methode, die zur Identifikation und zur quantitativen Bestimmung von Phthalaten in wässrigen und festen Matrices mithilfe einer parallelen Säulenkonfiguration und zwei Elektroneneinfangdetektoren (ECDs) verwendet wird [8]. Rtx-440 und Rxi-35Sil MS-Säulen sind ideal für eine Konfiguration mit zwei parallelen Säulen. Mithilfe der Pro EZGC-Software ließen sich geeignete Analysebedingungen für die Rtx-440-Säule schnell bestimmen, und die Rxi-35Sil MS-Säule diente dann aufgrund der beobachteten Änderungen in der Elutionsreihenfolge als ausgezeichnete Bestätigungssäule. Die GC-ECD-Bedingungen lassen sich unter Verwendung des kostenlosen online EZGC-Method Translators von Restek leicht aus den in Tabelle III gezeigten GC-MS-Methoden ableiten.
Schlussfolgerung
Die sieben am häufigsten verwendeten GC-Säulen für die Analyse von Phthalaten wurden mithilfe der Pro EZCG-Software, eines Tools zur flexiblen und einfachen GC-Optimierung, direkt verglichen. Die überlegene Selektivität und Trennleistung der Säulen Rtx-440 und Rxi-XLB ergab schnelle Analysezeiten für sowohl die regulierten als auch die Phthalate der erweiterten Liste. Mit guter Auflösung, hohen maximalen Betriebstemperaturen (340 °C für Rtx-440 und 360 °C für Rxi-XLB [Tabelle IV]) sowie minimalem Säulenbluten sind die Säulen Rtx-440 und Rxi-XLB die bevorzugte Wahl für die Analyse von Phthalaten mithilfe der GC-MS. Bei Verwendung eines GC-ECD Systems anstelle der GC-MS wird eine Konfiguration mit den beiden Säulen Rtx-440 und Rxi-35Sil MS empfohlen.
Tabelle IV: Maximaltemperaturen
| Rtx-440 (Art.-Nr. 12923) |
Rxi-XLB (Art.-Nr. 13723) |
Rxi-5ms (Art.-Nr. 13423) |
Rtx-50 (Art.-Nr. 10523) |
Rxi-35Sil MS (Art.-Nr. 13823) |
Rtx-CLPesticides (Art.-Nr. 11123) |
Rtx-CLPesticides2 (Art.-Nr. 11323) |
|
|---|---|---|---|---|---|---|---|
| Maximaltemperatur (°C) | 340 | 360 | 350 | 320 | 360 | 340 | 340 |
Danksagungen
Die Autoren bedanken sich bei der Shimadzu Corporation für ihre Unterstützung.
Literatur
- H. Choi, J. Kim, Y. Im, S. Lee, Y. Kim, The association between some endocrine disruptors and hypospadias in biological samples. J. Environ. Sci. Health, Part A: Toxic/Hazard. Subst. Environ. Eng. 47 (13) (2012) 2173–2179. http://www.ncbi.nlm.nih.gov/pubmed/22871016
- N. Nassar, P. Abeywardana, A. Barker, C. Bower, Parental occupational exposure to potential endocrine disrupting chemicals and risk of hypospadias in infants. Occup. Environ. Med. 67 (9) (2010) 585–589. http://www.ncbi.nlm.nih.gov/pubmed/19939854
- L. Trasande, S. Sathyanarayana, A.J. Spanier, H. Trachtman, T.M. Attina, E.M. Urbina, Urinary phthalates are associated with higher blood pressure in childhood. J. Pediatr. 163 (3) (2013) 747–753e1. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4074773/
- E.F. Werner, J.M. Braun, K. Yolton, J.C. Khoury, B.P. Lanphear, The association between maternal urinary phthalate concentrations and blood pressure in pregnancy: The HOME Study. Environ. Health 14 (2015) 75. http://www.ehjournal.net/content/14/1/75
- J.J. Jaakkola, T.L. Knight, The role of exposure to phthalates from polyvinyl chloride products in the development of asthma and allergies: A systematic review and meta-analysis. Environ. Health Perspect. 116 (7) (2008) 845–853. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2453150/
- E.E. Hatch, J.W. Nelson, R.W. Stahlhut, T.F. Webster, Association of endocrine disruptors and obesity: Perspectives from epidemiological studies. Int. J. Androl. 33 (2) (2010) 324–332. http://www.ncbi.nlm.nih.gov/pubmed/20113374
- S. Net, A. Delmont, R. Sempere, A. Paluselli, B. Ouddane, Reliable quantification of phthalates in environmental matrices (air, water, sludge, sediment and soil): A review. Sci. Total Environ. 515-516 (2015) 162–180. http://www.ncbi.nlm.nih.gov/pubmed/25723871
- U.S. Environmental Protection Agency, Method 8061A, Phthalate Esters by Gas Chromatography with Electron Capture Detection (GC/ECD), Rev. 1, December 1996. https://www.epa.gov/sites/production/files/2015-12/documents/8061a.pdf
Figure 1: EPA- and EU-listed phthalates and internal standard (benzyl benzoate) are shown under full scan mode and selected ion scan mode (m/z 293 and m/z 307) on seven different GC stationary phases (see Table III for conditions).
Rtx-440
| Peaks | |
|---|---|
| 1. | Dimethyl phthalate |
| 2. | Diethyl phthalate |
| 3. | Benzyl benzoate |
| 4. | Diisobutyl phthalate |
| 5. | Di-n-butyl phthalate |
| 6. | Bis(2-methoxyethyl) phthalate |
| 7. | Bis[4-methyl-2-pentyl] phthalate isomer 1 |
| 8. | Bis[4-methyl-2-pentyl] phthalate isomer 2 |
| 9. | Bis(2-ethoxyethyl) phthalate |
| 10. | Di-n-pentyl phthalate |
Rxi-XLB
Rtx-CLPesticides
Rtx-CLPesticides2
Continue reading
Figure 2: Target compounds on the extended phthalate list (50 µg/mL) are separated under full scan mode on an Rtx-440 column (see Table III for conditions).
Continue reading