QuEChERS をさらに簡単に: 包括的なソリューションでシンプルな前処理と分析を
QuEChERSで時間とコストを削減
- スリムパケット入りのさらさらとした抽出塩で、抽出操作がおこないやすくなります。
- 使いやすいQuEChERS製品、リファレンススタンダード、およびアクセサリを含めたトータルなラインナップ。
- サンプル前処理だけでなく、LCとGC両方の幅広い分離カラムで分析をサポートします。
|
チューブに入れやすいさらさらとしたQ-sep抽出塩。 |
この何年間もの間に、QuEChERSによるサンプル前処理は食の安全における検査をより簡便にしてきました。時間がかかり、溶媒を大量に消費する抽出技術と、複数の固相抽出カートリッジによるクリーンアップ手順が必要とされる時代は終わりを告げています。Quick(迅速)、Easy(簡単)、 Cheap(安価)、 Effective(効率的)、 Rugged(頑健)、そして Safe(安全)な QuEChERS法は、ペンシルベニア州ウィンドムアにあるアメリカ合衆国農務省東部地域研究センター[1]によって世界へ紹介されました。
QuEChERSでは、均質化されたサンプルは、すぐに簡単な抽出工程へと進みます。抽出は、抽出塩による分配力により有機溶媒層へと分析種を移動させることでおこなわれます抽出後、簡単で迅速な分散固相抽出(dSPE)を使ってサンプルクリーンアップをおこないます。 この簡単な2段階のプロセスは、時間、モノそして労力を大幅に削減し、QuEChERS法をその他の前処理法(表I)に比べて迅速かつ簡単にしています。
その導入以来、QuEChERS法は、ますます多様化する食品に含まれる農薬リストの拡大に対応するために進化してきました。Restekは、QuEChERS法の主要4メソッドをカバーするQ-Sep製品と、QuEChERS法をさらに簡単に実施するための関連製品を取り揃えています。QuEChERS法が初めての場合でも、あるいは新しいサンプルマトリックスに対するメソッド開発をおこなっている場合でも、RestekはQuEChERS法をより簡単におこなっていただくため、サンプル前処理に必要な様々な製品やリファレンススタンダード、LCおよびGCカラムを取り揃えています。もし、現在の農薬サンプルクリーンアップ手順に時間とコストをかけすぎてきるとお考えの場合は、このシンプルで経済的な手法を試してみてはどうでしょうか。
表 I: QuEChERSでサンプルをより迅速、簡単かつコスト効率よく前処理
|
Mini-Luke または Modified Luke Method |
QuEChERS |
QuEChERS法による削減 |
|
|
6サンプルあたりの時間 (min) |
120 |
30 |
1/4の時間 |
|
溶媒消費量 (mL) |
60-90 |
10 |
1/6-1/9の消費量 |
|
塩素系溶媒廃液量 (mL) |
20-30 |
0 |
安全、低コスト、地球にやさしい |
|
ガラス器具/専用器具 |
容量200 mL、石英ウール、漏斗、ウォーターバス、エバポレーター |
なし |
すぐに使えます |
迅速かつ簡単に...
2つのシンプルなステージでLCまたはGC分析用のサンプルを調製
QuEChERSは主に2つのステップがあり、それぞれのステップに対してQ-sep製品を選択します。 メソッドにおいて既に何を選択すべきか決まっているかもしれませんが、どれを使用すべきか不明な場合は、選択の際に考慮すべき事項があります。
ステージ 1: サンプル抽出
目的の分析種は、ブレンドされた抽出塩と有機溶媒を加えることでサンプルから抽出されます。塩は、抽出効率を高め、通常混和性の有機溶媒をサンプル中の水から分離することを可能にします。使用する抽出法の選択は、主に目的の分析種を考慮しておこなわれます。pHに敏感ではない化合物の場合は、 バッファーなしのオリジナル法 [1]でうまくいくでしょう。しかし、目的の化合物がpHに不安定な場合は、EN法 15662 [2]や mini-multiresidue 法 [3]、 AOAC法 2007.01 [4]のようにバッファーのあるメソッドを選択した方がよいでしょう。
Restekの Q-sep製品では、EN法 15662とmini-multiresidue法というヨーロッパの2つのメソッドは同じです。従って、ヨーロッパで開発された方法とAOAC法のいずれかが選択肢となります。どちらも、ほとんどの農薬が安定な範囲までpHを下げるためにバッファーが加えられており、緩衝塩とその比率が異なります。いずれの方法もほとんどの分析における出発点に適しています。ひとつのバッファー法がもう一つよりも良好な結果を示した特異的な例を示す報告はたくさんあります。そのような例を探して参考にすることでより実践的な提案を得ることができます。
| ステップ 1: アセトニトリルと内部標準を加え、激しく振り混ぜる。 | ステップ 2: 抽出塩を加え、振り混ぜた後に遠心分離しをおこなう。 |
ステージ 2: サンプルクリーンアップ
ステージ1で得られた有機溶媒抽出物のサブサンプルは、dSPEによってクリーンアップされます。抽出用製品の選択が主に目的化合物によっておこなわれるのに対し、クリーンアップの選択は、試験対象のサンプルに基づきます。Restek Q-sep dSPE製品は、異なる吸着剤を異なる比率で配合しています。このため、dSPEの選択は、特定のサンプルタイプの組成(例えば、脂肪、色素が多いなど)に合せて選びます。以下の表IIIを使用して、各吸着剤が除去するものを考慮し、特定のサンプルに適したdSPEを選択してください。
| ステップ 3: 上清をdSPEチューブへ移す。 |
ステップ 4: 振り混ぜて遠心分離後、上清をGCまたはLC分析用にオートサンプラバイアルへ移す。 |
効率的
QuEChERS dSPEクリーンアップは、農薬分析に最適な結果をもたらします
- ターゲット化合物に重なったり、イオンサプレッションをおこすマトリックスを除去します。
- GC注入口やLCおよびGCカラムの汚染を防ぎます。
- ピークの積分やマススペクトルの一致率が改善されます。
図 1: QuEChERS dSPE dSPEクリーンアップは測定対象の妨害となる物質を除去します。
|
抽出物を精製しない場合、マトリックスであるヘキサデカン酸は次の農薬のピークにかぶります。 |
||
|
allethrin |
diphenamid |
pendimethalin |
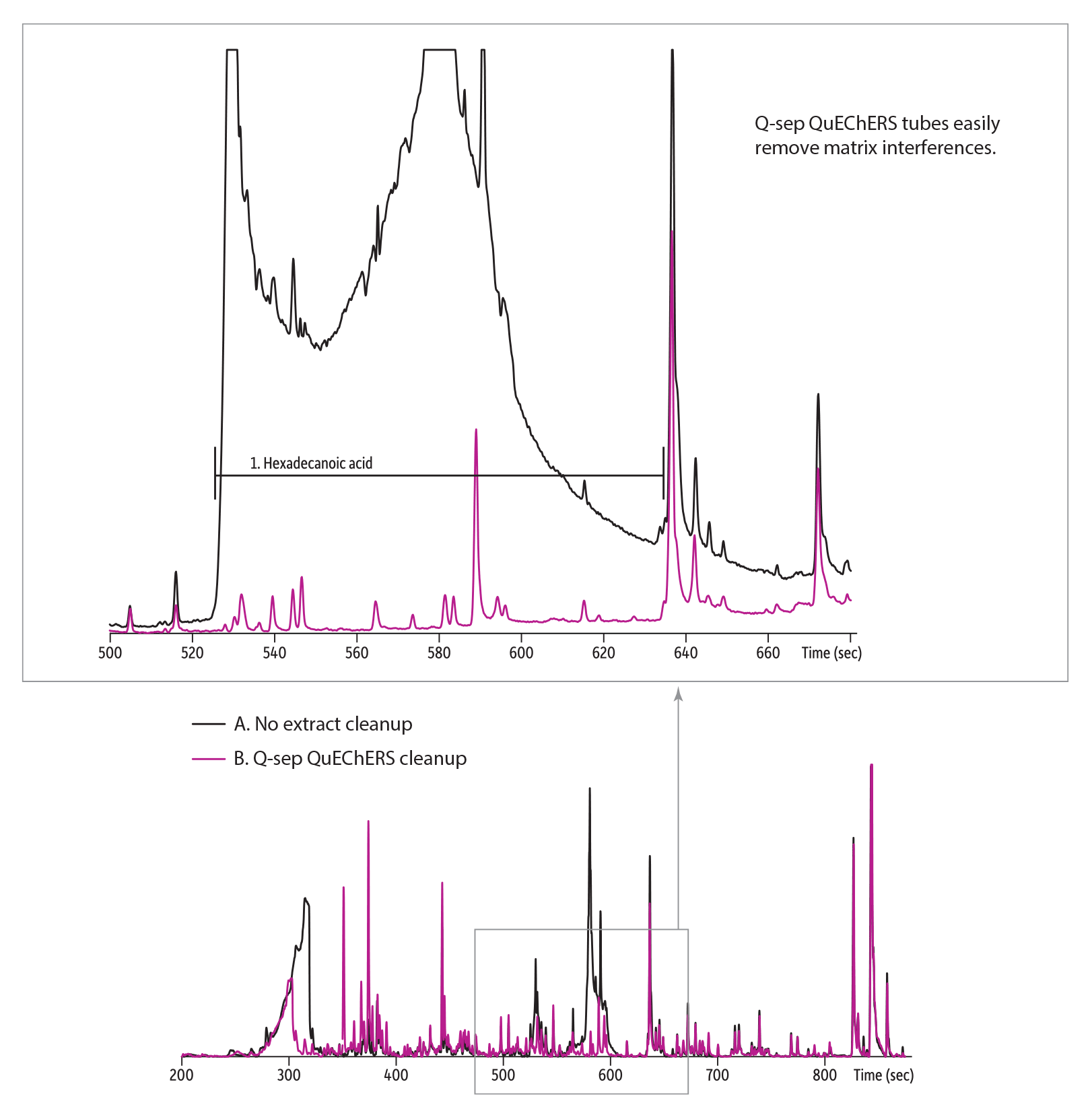
| Peaks | |
|---|---|
| 1. | Hexadecanoic acid |
| Column | Rxi-5Sil MS, 20 m, 0.18 mm ID, 0.18 µm (cat.# 43602) |
|---|---|
| Standard/Sample | Sweet potato spiked with pesticide mix and extracted with acetonitrile and Q-sep QuEChERS EN Method 15662 extraction salts |
| Injection | |
| Inj. Vol.: | 1.0 µL splitless (hold 1 min) |
| Liner: | Single taper (4 mm) w/deact. wool |
| Inj. Temp.: | 250 °C |
| Oven | |
| Oven Temp.: | 72.5 °C (hold 1 min) to 350 °C at 20 °C/min |
| Carrier Gas | He, constant flow |
| Flow Rate: | 1.2 mL/min |
| Detector | MS |
|---|---|
| Mode: | |
| Transfer Line Temp.: | 300 °C |
| Analyzer Type: | TOF |
| Ionization Mode: | EI |
| Acquisition Range: | 45-550 amu |
| Instrument | Agilent/HP6890 GC |
| Sample Preparation | A. Extract (without cleanup step) acidified with formic acid to pH 5. B. Extract with cleanup using Q-sep QuEChERS dSPE cleanup tube (cat.# 26124) acidified with formic acid to pH 5. |
| Notes | Liner cat.# 22405 was used to produce this chromatogram, but has since been discontinued. For assistance choosing a replacement for this application, contact Restek Technical Service or your local Restek representative. - - - - - - m/z 60, 73, 87, 129, 256 plotted |
図 2: QuEChERS dSPEによる精製は定量と同定の両方を改善します。
精製なしの場合、マトリックスがEndosulfan Iに被っています。
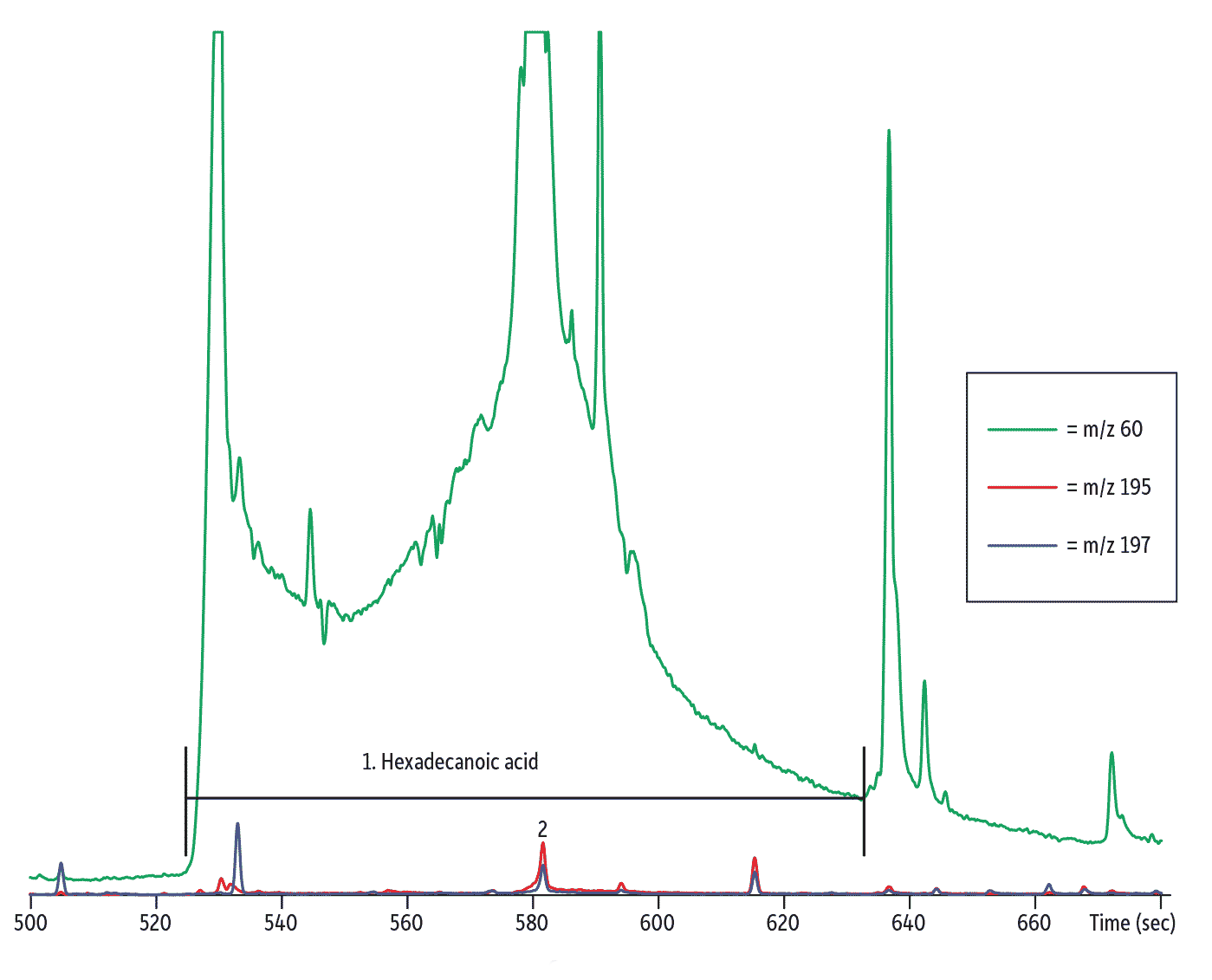
| Peaks | |
|---|---|
| 1. | Hexadecanoic acid |
| 2. | Endosulfan I |
| Column | Rxi-5Sil MS, 20 m, 0.18 mm ID, 0.18 µm (cat.# 43602) |
|---|---|
| Standard/Sample | Sweet potato spiked with pesticide mix and extracted with acetonitrile and Q-sep QuEChERS extraction salts, then acidified with formic acid to pH 5. |
| Injection | |
| Inj. Vol.: | 1 µL splitless (hold 1 min) |
| Liner: | Gooseneck splitless (4 mm) w/deact. wool |
| Inj. Temp.: | 250 °C |
| Oven | |
| Oven Temp.: | 72.5 °C (hold 1 min) to 350 °C at 20 °C/min |
| Carrier Gas | He, constant flow |
| Flow Rate: | 1.2 mL/min |
| Detector | MS |
|---|---|
| Mode: | |
| Transfer Line Temp.: | 300 °C |
| Analyzer Type: | TOF |
| Ionization Mode: | EI |
| Acquisition Range: | 45 to 550 amu |
| Instrument | LECO Pegasus III GC-TOFMS |
| Notes | Liner cat.# 22405 was used to produce this chromatogram, but has since been discontinued. For assistance choosing a replacement for this application, contact Restek Technical Service or your local Restek representative. - - - - - - m/z 60, 195, 197 shown |
QuEChERS dSPEによる精製は定量と同定の両方を改善します。
ピークの積分 (抽出イオンクロマトグラム)
吸着剤選択による分析の最適化
QuEChERS dSPE吸着剤の選択
PSA(Primary and secondary amine exchange)は、果物や野菜のQuEChERS dSPE 精製に使用される基本の吸着剤です。PSA は分析に影響を及ぼす可能性のある有機酸や糖を除去します。さらに、C18 は脂質を、GCB(Graphitezed carbon black)は色素を主に除去します。吸着剤は、マトリックスの組成や分析対象化合物の化学的性質に基づいて選択する必要があります。ほとんどの方法には、追加の検討を必要とするような酸性、塩基性および平面構造を持つ農薬に対する推奨事項があります。
表IIに示したように、GCB はクロロタロニルやチアベンダゾールのような平面構造を持つ農薬の回収率に影響を及ぼします。ここでは、GCB の効果を顕著にするために、抽出液1mL あたり50mg のGCBを使用しました。EN 15662 QuEChERS法は、平面農薬の回収率を改善するためにGCBの量を減らすことを推奨していますが、GC-MSのパフォーマンスを低下させる可能性のある色素は除去できるとしています。サンプル前処理を簡単かつ迅速におこなえるよう、Restek QuEChERS チューブは、EN 15662もしくはAOAC 法で指定された吸着剤の組合せと量だけでなく、難しいマトリックスにより良い結果をもたらすようなその他の組合せも提供しています(表III)。
表 II: マトリックスと目的化合物の化学的性質に基づいて吸着剤を選択します。(PSAのみに対して、C18またはGCBを使用した回収率)
|
tR (min) |
Pesticide |
CAS Number |
Action/Use |
Classification |
C18* |
GCB** |
|
9.50 |
Dichlorvos |
62-73-7 |
insecticide |
organophosphorus |
111 |
116 |
|
9.67 |
Methamidophos |
10265-92-6 |
insecticide |
organophosphorus |
105 |
107 |
|
11.75 |
Mevinphos |
7786-34-7 |
insecticide |
organophosphorus |
112 |
130 |
|
12.02 |
o-phenylphenol |
90-43-7 |
fungicide |
unclassified |
106 |
97 |
|
12.14 |
Acephate |
30560-19-1 |
insecticide |
organophosphorus |
128 |
147 |
|
13.89 |
Omethoate |
1113-02-6 |
insecticide |
organophosphorus |
120 |
119 |
|
14.74 |
Diazinon |
333-41-5 |
insecticide |
organophosphorus |
108 |
127 |
|
14.98 |
Dimethoate |
60-51-5 |
insecticide |
organophosphorus |
124 |
151 |
|
15.69 |
Chlorothalonil |
1897-45-6 |
fungicide |
organochlorine |
125 |
13 |
|
15.86 |
Vinclozolin |
50471-44-8 |
fungicide |
organochlorine |
102 |
98 |
|
16.21 |
Metalaxyl |
57837-19-1 |
fungicide |
organonitrogen |
105 |
117 |
|
16.28 |
Carbaryl |
63-25-2 |
insecticide |
carbamate |
114 |
111 |
|
16.60 |
Malathion |
121-75-5 |
insecticide |
organophosphorus |
124 |
160 |
|
16.67 |
Dichlofluanid |
1085-98-9 |
fungicide |
organohalogen |
122 |
103 |
|
17.51 |
Thiabendazole |
148-79-8 |
fungicide |
organonitrogen |
88 |
14 |
|
17.70 |
Captan |
133-06-2 |
fungicide |
organochlorine |
88 |
91 |
|
17.76 |
Folpet |
133-07-3 |
fungicide |
organochlorine |
108 |
63 |
|
18.23 |
Imazalil |
35554-44-0 |
fungicide |
organonitrogen |
115 |
95 |
|
18.39 |
Endrin |
72-20-8 |
insecticide |
organochlorine |
104 |
101 |
|
18.62 |
Myclobutanil |
88671-89-0 |
fungicide |
organonitrogen |
119 |
114 |
|
19.07 |
4,4-DDT |
50-29-3 |
insecticide |
organochlorine |
102 |
95 |
|
19.22 |
Fenhexamid |
126833-17-8 |
fungicide |
organochlorine |
118 |
77 |
|
19.40 |
Propargite 1 |
2312-35-8 |
acaricide |
organosulfur |
110 |
95 |
|
19.43 |
Propargite 2 |
2312-35-8 |
acaricide |
organosulfur |
121 |
114 |
|
19.75 |
Bifenthrin |
82657-04-3 |
insecticide |
pyrethroid |
106 |
81 |
|
20.04 |
Dicofol |
115-32-2 |
acaricide |
organochlorine |
98 |
54 |
|
20.05 |
Iprodione |
36734-19-7 |
fungicide |
organonitrogen |
118 |
90 |
|
20.21 |
Fenpropathrin |
39515-41-8 |
insecticide |
pyrethroid |
113 |
96 |
|
21.32 |
cis-Permethrin |
52645-53-1 |
insecticide |
pyrethroid |
106 |
65 |
|
21.47 |
trans-Permethrin |
51877-74-8 |
insecticide |
pyrethroid |
109 |
71 |
|
23.74 |
Deltamethrin |
52918-63-5 |
insecticide |
pyrethroid |
97 |
52 |
農薬200ng/mLを添加したイチゴ抽出物をPSAのみのdSPEに供しました。結果を使用して、一点検量線を作成しました。次いで、添加抽出液をさらなるdSPE吸着剤(C18またはGCBのいずれか)に供しました。結果は、PSAのみと比較した回収率として示されています。
表 III: Restek Q-sep dSPE製品は、吸着剤の種類と比率の組合せを豊富に用意しています。このため、特定のサンプルタイプ(脂肪、色素など)に合わせてdSPEを選択することができます。
| メソッド | 吸着剤量 (mg) | 製品情報 | ||||
|
MgSO₄ |
PSA* |
C18-EC |
GCB** |
バイアル容量 (mL) |
Cat.# |
|
| 除去対象 | ||||||
|
水分 |
糖類、脂肪酸、有機酸、 アントシアニン色素 |
脂質、無極性の マトリックス |
色素、ステロール、 無極性のマトリックス |
|||
| サンプルタイプ: 一般的な果物と野菜 例: セロリ、レタス、キュウリ、メロン |
||||||
|
AOAC 2007.01 |
150 |
50 |
- |
- |
2 |
26124 |
|
Original unbuffered, EN 15662, mini-multiresidue |
150 |
25 |
- |
- |
2 |
26215 |
|
AOAC 2007.01 |
1200 |
400 |
- |
- |
15 |
26220 |
|
Original unbuffered, EN 15662 |
900 |
150 |
- |
- |
15 |
26223 |
| サンプルタイプ: 脂肪やワックスを含む食品 例: シリアル、アボカド、ナッツ、種子、乳製品 |
||||||
|
Mini-multiresidue |
150 |
25 |
25 |
- |
2 |
26216 |
|
- |
150 |
- |
50 |
- |
2 |
26242 |
|
AOAC 2007.01 |
150 |
50 |
50 |
- |
2 |
26125 |
|
AOAC 2007.01 |
1200 |
400 |
400 |
- |
15 |
26221 |
|
- |
1200 |
- |
400 |
- |
15 |
26244 |
|
- |
900 |
150 |
150 |
- |
15 |
26226 |
| サンプルタイプ: 色素を含む果物や野菜 例: イチゴ、サツマイモ、トマト |
||||||
| Mini-multiresidue, EN 15662 | 150 | 25 | - | 2.5 | 2 | 26217 |
|
AOAC 2007.01 |
150 |
50 |
- |
50 |
2 |
26123 |
|
AOAC 2007.01 |
1200 |
400 |
400 |
400 |
15 |
26222 |
|
EN 15662 |
900 |
150 |
- |
15 |
15 |
26224 |
| サンプルタイプ: 色素の多い果物や野菜 例: 赤唐辛子、ほうれん草、ブルーベリー |
||||||
|
Mini-multiresidue, EN 15662 |
150 |
25 |
- |
7.5 |
2 |
26218 |
|
AOAC 2007.01 |
150 |
50 |
50 |
50 |
2 |
26219 |
|
EN 15662 |
900 |
150 |
- |
45 |
15 |
26225 |
|
- |
900 |
300 |
- |
150 |
15 |
26126 |
| サンプルタイプ: 汎用 例: 脂肪や色素を含有する果物や野菜を含めた幅広い食品 |
||||||
|
- |
150 |
50 |
50 |
7.5 |
2 |
26243 |
|
- |
900 |
300 |
300 |
45 |
15 |
26245 |
*PSA = primary secondary amine exchange material
**GCB = graphitized carbon black
QuEChERSを今すぐ試してみましょう!
Q-sep QuEChERSチューブの無料サンプルパックをご希望の場合は、Restek株式会社にご連絡ください。
参考文献
Restekからこれらの文書のコピーを提供することはできません。
- M. Anastassiades, S.J. Lehotay, D. Stajnbaher, F.J. Schenck, Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce. J. AOAC Int. 86 (2003) 412-431. http://pubag.nal.usda.gov/pubag/downloadPDF.xhtml?id=555&content=PDF
- EN 15662, Foods of Plant Origin—Determination of Pesticide Residues Using GC-MS and/or LC-MS/MS Following Acetonitrile Extraction/Partitioning and Clean-up by Dispersive SPE—QuEChERS method, 2008.
- QuEChERS-A Mini-Multiresidue Method for the Analysis of Pesticide Residues in Low-Fat Products, 2004. http://quechers.cvua-stuttgart.de/pdf/reality.pdf
- AOAC Official Method 2007.01, Pesticide Residues in Foods by Acetonitrile Extraction and Partitioning with Magnesium Sulfate, 2007.

