Multi-Mykotoxin-Methode für Alternaria-Toxine, Epimere der Ergotalkaloiden und andere weitverbreitete Mykotoxine in Lebensmitteln
Vorgestellte Applikation: Mykotoxine auf Raptor Biphenyl
- Werden Sie produktiver - Integrieren Sie neue Mykotoxine in Ihre bestehende Mykotoxine Methode!
- Sparen Sie sich zusätzliche Läufe bei hohen pH-Werten - die Raptor Biphenyl analysiert alle Mykotoxin-Gruppen quantitativ unter MS-kompatiblen sauren Bedingungen.
- Die einfache, universelle Probenvorbereitung spart Zeit und erfordert keine weiteren Reinigungsschritte.
Die zunehmende gesetzliche Regulierung der Mykotoxine erfordert eine neue Art der Methodenentwicklung um einen effizienten Betrieb der Lebensmittellabore zu gewährleisten. Umfassende Multi-Mykotoxin-Methoden wären eine attraktive Alternative, verglichen mit der Entwicklung separater Methoden für die unterschiedlichen Analytenlisten. Die Entwicklung einer einzigen Methode kann jedoch aufgrund des breiten Spektrums an chemischen Eigenschaften der unterschiedlicher Mykotoxin-Klassen schwierig sein. Insbesondere die Alternaria- Toxine und die Ergotalkaloide stellen die Methodenentwicklung vor Herausforderungen. Werden diese Kontaminanten auf einer C18-Phase analysiert, muss bei hohen pH-Werten gearbeitet werden, um eine akzeptable Peakform für die Alternaria-Toxine und eine angemessene Trennung der Epimere der Ergotalkaloide zu erzielen. Die Nutzung im Alkalischen ist jedoch für LC-Säulen belastend und für die Analyse anderer Klassen von Mykotoxinen nicht geeignet, so dass für eine wirklich umfassende Multi-Methode ein anderer Ansatz erforderlich ist.
Hier beschreiben wir wie Altarnaria Toxine, Ergotalkaloid-Epimere und andere häufig vorkommende Mykotoxine gleichzeitig analysiert werden mittels einer einfachen Probenvorbereitung und einer Trennung im Sauren auf einer Raptor Biphenyl-Säule. Unter diesen Säulenund MS-kompatiblen Bedingungen konnte in einem schnellen Lauf mit einer Gesamtzykluszeit von 11 Minuten, 37 regulierte und neu aufgetretene Mykotoxine quantitativ analysiert werden (einschließlich der Alternaria-Toxine und aller sechs essentiellen Ergotalkaloide und deren Epimere). In einer separaten Studie wurde die Leistungsfähigkeit der Methode in Weizen-Babynahrung, Erdnüssen, Tomatenpüree und Mischmehl verifiziert, um die Anwendbarkeit dieser Methode für eine Vielzahl von Lebensmitteln zu demonstrieren [1]. Die Quantifizierung wurde mit matrixangepassten Standards durchgeführt, da für die meisten Mykotoxine keine isotopenmarkierten Standards zur Verfügung standen. Die Verwendung unserer Multi-Mykotoxin-Methode auf der Raptor Biphenyl ermöglicht es Lebensmittellaboren ihre Produktivität deutlich zu steigern - verglichen mit der Verwendung separater Methoden für unterschiedliche Mykotoxin-Panels.
Abbildung 1: Steigern Sie Ihre Produktivität durch Verwendung einer einzigen Multi-Mykotoxin-Methode für die gleichzeitige Analyse von 37 wichtiger Mykotoxine, einschließlich der Alternaria-Toxine und der Ergotalkaloid-Epimere (Probe aus Mischmehl).
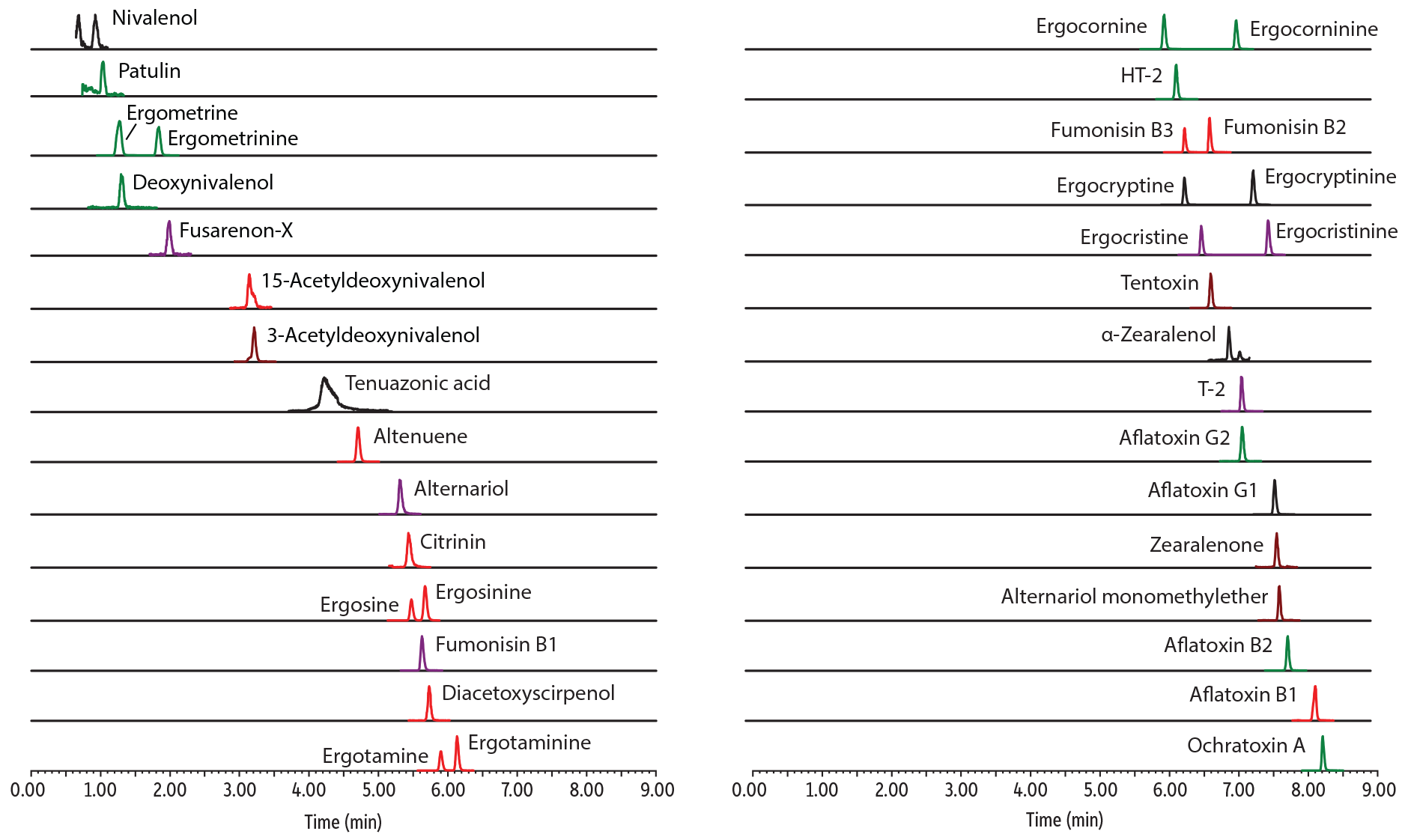
| Peaks | tR (min) | Precursor Ion | Product Ion 1 | Product Ion 2 | |
|---|---|---|---|---|---|
| 1. | Nivalenol | 0.92 | 295.1 | 137.1 | 91.0 |
| 2. | Patulin | 1.03 | 155.0 | 99.0 | 81.0 |
| 3. | Ergometrine | 1.27 | 326.2 | 223.2 | 208.1 |
| 4. | Deoxynivalenol | 1.30 | 297.2 | 231.0 | 249.0 |
| 5. | Ergometrinine | 1.83 | 326.2 | 223.2 | 208.1 |
| 6. | Fusarenon-X | 1.98 | 355.1 | 137.1 | 247.1 |
| 7. | 15-Acetyldeoxynivalenol | 3.14 | 339.2 | 137.1 | 321.2 |
| 8. | 3-Acetyldeoxynivalenol | 3.21 | 339.2 | 213.1 | 231.1 |
| 9. | Tenuazonic acid | 4.22 | 198.1 | 125.0 | 153.1 |
| 10. | Altenuene | 4.70 | 293.2 | 257.1 | 275.2 |
| 11. | Alternariol | 5.30 | 259.0 | 185.1 | 130.0 |
| 12. | Citrinin | 5.43 | 251.2 | 233.1 | 205.1 |
| 13. | Ergosine | 5.47 | 548.4 | 208.1 | 223.2 |
| 14. | Fumonisin B1 | 5.63 | 722.5 | 352.3 | 334.2 |
| 15. | Ergosinine | 5.67 | 548.4 | 208.1 | 223.2 |
| 16. | Diacetoxyscirpenol | 5.73 | 384.2 | 247.1 | 307.2 |
| 17. | Ergotamine | 5.90 | 582.4 | 223.2 | 268.2 |
| 18. | Ergocornine | 6.03 | 562.4 | 268.2 | 223.2 |
| Peaks | tR (min) | Precursor Ion | Product Ion 1 | Product Ion 2 | |
|---|---|---|---|---|---|
| 19. | Ergotaminine | 6.13 | 582.4 | 223.2 | 268.2 |
| 20. | HT-2 | 6.20 | 447.2 | 345.1 | 285.1 |
| 21. | Fumonisin B3 | 6.32 | 706.4 | 336.2 | 318.3 |
| 22. | Ergocryptine | 6.32 | 576.4 | 268.2 | 223.2 |
| 23. | Ergocristine | 6.56 | 610.4 | 223.2 | 592.4 |
| 24. | Fumonisin B2 | 6.68 | 706.4 | 336.2 | 318.3 |
| 25. | Tentoxin | 6.70 | 415.2 | 312.2 | 302.2 |
| 26. | α-Zearalenol | 6.96 | 303.1 | 285.1 | 175.0 |
| 27. | Ergocorninine | 7.07 | 562.4 | 268.2 | 223.2 |
| 28. | T-2 | 7.14 | 489.2 | 387.1 | 245.1 |
| 29. | Aflatoxin G2 | 7.15 | 331.2 | 189.0 | 313.0 |
| 30. | Ergocryptinine | 7.31 | 576.4 | 268.2 | 223.2 |
| 31. | Ergocristinine | 7.53 | 610.4 | 223.2 | 592.4 |
| 32. | Aflatoxin G1 | 7.62 | 329.1 | 199.7 | 243.0 |
| 33. | Zearalenone | 7.65 | 319.2 | 283.1 | 187.0 |
| 34. | Alternariol monomethylether | 7.69 | 273.0 | 199.1 | 128.0 |
| 35. | Aflatoxin B2 | 7.81 | 315.1 | 287.0 | 259.0 |
| 36. | Aflatoxin B1 | 8.20 | 313.2 | 241.1 | 284.9 |
| 37. | Ochratoxin A | 8.31 | 404.1 | 239.0 | 358.0 |
| Column | Raptor Biphenyl (cat.# 9309A12) | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 100 mm x 2.1 mm ID | ||||||||||||||||||||||||
| Particle Size: | 2.7 µm | ||||||||||||||||||||||||
| Pore Size: | 90 Å | ||||||||||||||||||||||||
| Guard Column: | Raptor Biphenyl EXP guard column cartridge 5 mm, 2.1 mm ID, 2.7 µm (cat.# 9309A0252) | ||||||||||||||||||||||||
| Temp.: | 60 °C | ||||||||||||||||||||||||
| Standard/Sample | Aflatoxins standard (cat.# 34121) | ||||||||||||||||||||||||
| Ochratoxin A standard (cat.# 34122) | |||||||||||||||||||||||||
| Diluent: | 50:50 Water:methanol | ||||||||||||||||||||||||
| Conc.: | 6.25 ng/mL final concentration after sample preparation | ||||||||||||||||||||||||
| Inj. Vol.: | 5 µL | ||||||||||||||||||||||||
| Mobile Phase | |||||||||||||||||||||||||
| A: | Water, 0.05% formic acid | ||||||||||||||||||||||||
| B: | Methanol, 0.05% formic acid | ||||||||||||||||||||||||
|
| Detector | MS/MS |
|---|---|
| Ion Mode: | ESI+ |
| Mode: | MRM |
| Instrument | UHPLC |
| Sample Preparation | A blended flour was prepared by mixing white rice flour (75%); brown rice flour (5%); millet flour (5%); oat flour (5%); all-purpose wheat flour (5%); and all-purpose, gluten-free flour (5%). Two grams of the flour sample were weighed into a 50-mL polypropylene centrifuge tube (cat.# 25846) and fortified at 50 µg/kg for all analytes with a stock standard solution. After sitting at room temperature for 10 minutes, 16 mL of extraction solution (80:20 acetonitrile:water) containing 0.5% formic acid were added, and the tube was stirred to create a homogenous suspension. The extraction was carried out by shaking horizontally on a digital pulse mixer (Glas-Col LLC, Terre Haute, IN) at 800 rpm for 20 minutes. After centrifuging for 5 minutes at 4000 rpm, 1 mL of extract was evaporated to dryness at 45 °C under a gentle stream of nitrogen. The dried extract was reconstituted with 1 mL of 50:50 water:methanol solution, and a 0.4 mL aliquot was transferred to and filtered using a Thomson SINGLE StEP filter vial with a 0.2 µm PTFE filter (cat.# 25874). Five µL of the filtered solution was injected for the LC-MS/MS analysis. |
| Notes | The chromatogram shows peaks with the MS transition of product ion 1. Note that method development work demonstrated that whenever a new column is installed it must be rinsed and maintained under mobile phase overnight to ensure an acceptable peak shape for tenuazonic acid. Want even better performance when analyzing metal-sensitive compounds? Check out Inert LC columns at www.restek.com/inert. |
Literaturhinweise
- H. Liang, J. York, J. Konschnik, H. Majer, J. Steimling, Comprehensive mycotoxin analysis: simultaneous determination of Alternaria toxins, ergot alkaloid epimers, and other major mycotoxins in various food matrices by LC-MS/MS, Restek Corporation, 2022.

