Ottimizzare l’analisi GC-MS e GC-MS/MS del 3-MCPD e dei glicidili esteri negli oli alimentari
Abstract
Il 3-MCPD e i glicidil esteri negli oli alimentari sono contaminanti che si formano durante i processi di raffinazione e sono stati classificati come potenzialmente cancerogeni per gli esseri umani. ISO, AOCS e DGF hanno sviluppato dei metodi per l’analisi del 3-MCPD e dei glicidil esteri che descrivono dettagliatamente le tecniche di estrazione e derivatizzazione, ma non forniscono molte indicazioni sul metodo di analisi GC-MS. Con l’emergere di sistemi automatizzati in grado di sveltire la preparazione dei campioni, è importante semplificare e velocizzare l’analisi ottimizzando le condizioni del metodo e le tecniche di iniezione.
La nostra ottimizzazione iniziale del programma di temperatura del forno GC ci ha consentito di ridurre il tempo di analisi di 8 minuti; tuttavia è possibile risparmiare più tempo utilizzando il software gratuito per lo sviluppo di metodi (modellatore di cromatogrammi Pro EZGC). I metodi attualmente pubblicati raccomandano l’utilizzo degli iniettori split/splitless o PTV azionati in modalità splitless. Esaminando l’iniezione split abbiamo osservato dei miglioramenti inaspettati delle forme del picco. Tuttavia, contrariamente alle aspettative, la tecnica di iniezione split ha anche raggiunto limiti di rilevabilità simili a quelli ottenuti con il metodo di iniezione splitless.
Introduzione
Gli esteri del 3-monocloropropandiolo (3-MCPD) sono contaminanti presenti in vari oli raffinati e si formano a partire dagli acilgliceroli presenti naturalmente in composti clorurati durante i processi di deodorizzazione ad alta temperatura [1] Negli oli raffinati la concentrazione è variabile, e i quantitativi maggiori si trovano nell’olio di palma e di noci. Studi effettuati su animali mostrano che gli esteri del 3-MCPD vengono idrolizzati nell’apparato gastrointestinale per rilasciare il 3-MCPD, una sostanza tossica. Nei ratti e nei topi, gli organi in cui si registrano i maggiori effetti tossici sono i reni e il sistema riproduttivo maschile [2].
Anche i glicidil esteri sono contaminanti presenti negli oli raffinati, ma sono generati da un processo diverso da quello degli esteri del 3-MCPD [3]. I glicidil esteri si formano a partire dai diacilgliceroli ad alte temperature (>240 °C), e la reazione avviene anche in assenza di composti clorurati. Dopo il consumo hanno un destino simile a quello degli esteri del 3-MCPD, ovvero vengono idrolizzati in glicidolo nell'apparato gastrointestinale. Studi condotti sugli animali hanno dimostrato che il glicidolo è genotossico e cancerogeno. La figura 1 mostra le strutture chimiche di questi composti.
Figura 1: Strutture chimiche del 3-MCPD, degli esteri del 3-MCPD, del glicidolo e dei glicidil esteri.
Con il tentativo dell’industria alimentare di ridurre sempre più l’utilizzo di oli parzialmente idrogenati, gli acidi grassi trans non sono più considerati un argomento di studio prioritario. Ora al centro delle analisi vi sono i derivati dalla raffinazione dell’olio. Il 3-MCPD e i glicidil esteri (GE) sono sostanze sospettate di essere cancerogene e sebbene la Food and Drug Administration (FDA) americana non preveda limiti, l’Autorità europea per la sicurezza alimentare (EFSA) ha stabilito una dose giornaliera tollerabile di 3-MCPD pari a 2 µg per kg peso corporeo [4]. L’Unione europea (UE) ha fissato i seguenti limiti massimi per il contenuto di esteri del 3-MCPD negli oli: 1,25 mg/kg per gli oli raffinati e non raffinati selezionati, quali l’olio di oliva (eccetto l’olio di sansa), l’olio di girasole, l’olio di soia, l’olio di semi di palma, e 2,5 mg/kg per altri oli vegetali raffinati e oli marini e di pesce [5].
Per le analisi degli isomeri degli esteri del MCPD e dei glicidil esteri si possono utilizzare due approcci, diretto o indiretto. Il metodo diretto solitamente implica l’impiego di un sistema LC-MS in grado di fornire informazioni complete sulla composizione dei campioni senza trasformazioni chimiche del MCPD o dei glicidil esteri. Senza la fase di transesterificazione non dovrebbe verificarsi la trasformazione degli esteri del MCPD in glicidil esteri e viceversa, sebbene l’alto contenuto di trigliceridi dovrebbe essere eliminato per impedire una sottostima dei composti target causata da queste interferenze. Durante questa fase occorre fare attenzione per garantire che attraverso la procedura di purificazione dei campioni non vengano eliminati anche il MCPD e i glicidil esteri. Inoltre, sono necessari standard specifici per una quantificazione precisa degli esteri, nonché strumenti altamente sensibili, come uno strumento MS ad alta risoluzione, per la loro determinazione.
Il secondo approccio consiste in un'analisi indiretta. Questa metodologia è più adatta ad analisi ordinarie in quanto è necessaria una quantità di standard nettamente inferiore e la preparazione dei campioni può avvenire tramite un sistema automatizzato. Tali standard comprendono i tre metodi AOCS (Cd 29a-13, Cd 29b-13 e Cd 29c-13) per l’analisi del MCPD e dei glicidil esteri negli oli alimentari. Tutti e tre i metodi seguono un iter simile: transesterificazione per convertire i trigliceridi in esteri metilici degli acidi grassi (FAME); neutralizzazione delle condizioni alcaline derivanti dalla transesterificazione; estrazione dei FAME come fase di purificazione. All’estrazione del MCPD libero e del glicidolo [trasformato in MCPD o in monobromopropandiolo (MBPD) a seconda del metodo specifico scelto] segue la derivatizzazione con acido fenilboronico (PBA) per migliorare la volatilità degli analiti rendendoli più inclini alla separazione GC e all’analisi MS o MS/MS. Questi metodi descrivono dettagliatamente la manipolazione dei campioni, ma non forniscono molte indicazioni relativamente al metodo di analisi GC-MS. L’emergere di sistemi automatizzati per la preparazione dei campioni consente di sveltire tale procedura. È inoltre possibile ottimizzare il metodo analitico per migliorare le prestazioni globali.
Grazie ai metodi AOCS è possibile infatti ottimizzare il programma di temperatura del forno per velocizzare l’analisi, il che, pur non comportando necessariamente un aumento della produzione di campioni perché anche i processi automatizzati per la preparazione dei campioni potrebbero durare più a lungo dell’analisi stessa, offre sicuramente l’opportunità di condizionare con maggiore cura la colonna tra un’analisi e l’altra o persino semplicemente di consentire misure di contenimento dei costi come la riduzione del flusso di gas tra un’analisi e l’altra.
Oltre al programma di temperatura del forno, è stata analizzata anche la tecnica di iniezione per determinare se con le iniezioni split si potessero ottenere risultati accettabili. Di norma, i metodi prevedono l’utilizzo di iniezioni splitless mediante iniettori split/splitless o con vaporizzazione a temperatura programmabile (PTV); tuttavia, impiegando un’iniezione split, in particolare per i metodi di preparazione dei campioni che prevedono la derivatizzazione degli analiti, è possibile ridurre drasticamente la quantità di reagente di derivatizzazione che viene trasferito alla colonna e, di conseguenza, aumentare potenzialmente la durata della colonna.
Abbiamo valutato l’utilizzo di due iniettori diversi (PTV e split/splitless), come pure due modalità di iniezione (split e splitless) a varie temperature. La valutazione delle prestazioni del metodo si è basata su limiti di rilevabilità strumentali (limits of detection, LOD) e sulla sensibilità del metodo misurata mediante la pendenza della curva di calibrazione.
Studio sperimentale
Sostanze chimiche e materiali
I solventi di grado LC-MS sono stati acquistati presso Fisher Scientific. L’etere dietilico, il 3-MCPD libero, il metossido di sodio (in metanolo 25%), l’idrossido di sodio, il cloruro di sodio, il bromuro di sodio, l’acido solforico (25%), l’acido ortofosforico (85%) e l’acido fenilboronico sono stati acquistati presso Sigma Aldrich. Il 2-MCPD libero, il 2-MCPD-d5 e il glicidil-d5 stearato, sono stati acquistati presso Toronto Research Chemicals. Le soluzioni di dipalmitato-3-MCPD, dipalmitato-3-MCPD-d5 e glicidil stearato erano standard custom di Restek Corporation. Gli standard sono stati conservati a una temperatura di -20 °C. Per fornire una matrice bianca, l’olio extra vergine di oliva (EVOO) è stato acquistato da un negozio di alimentari locale e conservato al buio a temperatura ambiente.
Preparazione del campione
Gli standard custom Restek sono stati utilizzati come soluzioni di lavoro unitamente a soluzioni preparate con materiali puliti. Gli standard di calibrazione (esteri di 3-MCPD o glicidil esteri) sono stati preparati per coprire un range di 0,002–12 mg/kg nell’olio.
Per l’analisi sono stati successivamente preparati campioni di EVOO fortificato utilizzando versioni modificate dei metodi AOCS Cd 29b-13 e Cd 29c-13 (la Figura 2 mostra lo schema del metodo Cd 29c-13). Le modifiche ai metodi pubblicati sono state effettuate principalmente per ridurre la quantità di solvente utilizzato. I campioni di olio in entrambi i protocolli sono stati dissolti nel metil-t-butil etere (in sostituzione dell’etere dietilico nel metodo Cd 29b-13). Durante la seconda fase di estrazione (Figura 2), la quantità di acetato di etilene/etere dietilico è stata ridotta a 500 µL a estrazione (totale 1,5 mL). I campioni utilizzati a fini qualitativi sono stati lasciati nel solvente a base di acetato di etilene/etere dietilico. Per ulteriori dettagli sui metodi si rimanda al relativo metodo AOCS.
Figura 2: Procedura di preparazione dei campioni secondo AOCS Cd 13c-29.
Modello Pro EZGC
La versione online del software Restek del modellatore di cromatogrammi Pro EZGC (www.restek.com/it/ezgc) è uno strumento di selezione che si basa su una libreria precaricata di indici di ritenzione termodinamici. Gli indici di ritenzione termodinamici sono stati generati per le colonne Rxi-17Sil MS. Per generare gli indici sono stati utilizzati i seguenti composti: 3-MCPD, 3-MCPD-d5, 2-MCPD, 2-MCPD-d5 liberi, glicidil estere, e glicidil-d5 estere. Il 3-MCPD, il 3-MCPD-d5 , il 2-MCPD, il 2-MCPD-d5 liberi sono stati dissolti nell’acetato di etilene e derivatizzati con PBA prima dell’analisi. Il glicidil estere e il glicidil-d5 estere sono stati trasformati rispettivamente in 3-MBPD e 3-MBPD-d5 liberi, e poi derivatizzati con PBA secondo il metodo AOCS Cd 29b-13 modificato. I campioni per il modello Pro EZGC sono stati preparati in concentrazioni di 50-100 µg/mL.
Strumentazione
Per gli esperimenti per l’ottimizzazione del metodo e le analisi a concentrazione più elevata è stato utilizzato un Agilent 7890A GC abbinato a un 5975C MSD. Per le analisi delle tracce è stato utilizzato un Thermo Fisher Scientific Trace 1310 GC abbinato a un TSQ 8000 MS/MS. Per il trattamento dei dati sono stati utilizzati i software Agilent MSD Chemstation (versione F.01.03) e Thermo Scientific TraceFinder (versione 4.1 EFS). I test sono stati effettuati utilizando due colonne Rxi-17Sil MS di dimensioni 30 m x 0,25 mm x 0,25 µm (cat. n° 14123) e 20 m x 0,18 mm x 0,18 µm (cat. n° 14102). La colonna da 20 m è stata utilizzata nello strumento Agilent, quella da 30 m in entrambi gli strumenti. Un Topaz Liner a cono singolo con ID 2,0 mm con lana di vetro è stato utilizzato per lo strumento Agilent (cat. n° 23316), e un Topaz Baffled Liner con ID 2,0 mm per PTV è stato utilizzato per lo strumento Thermo (cat. n° 23438). In entrambi gli strumenti è stato utilizzato un flusso costante di elio. I programmi di temperatura per gli iniettori e i forni delle colonne sono indicati nella tabella I. Le impostazioni iniziali sono state desunte dai metodi AOCS Cd 29b-13 e Cd 29c-13. Per determinare i programmi finali, la temperatura iniziale di entrambi i programmi PTV e GC è stata variata tra 85 °C e 120 °C.
Tabella I: Programmi di temperatura dell’iniettore e del forno.
| Metodo | Programma finale | |
|---|---|---|
| Colonna da 20 m |
Nessuno |
PTV: 120 °C fino a 165 °C a 300 °C/min (mantenimento 10 min) fino a 320 °C a 300 °C/min (mantenimento 8 min). GC: 120 °C (mantenimento 0,5 min) fino a 200 C a 18,5°C/min fino a 330 °C a 35 °C/min (mantenimento 5 min). |
| Colonna da 30 m |
PTV: 85 °C fino a 165 °C a 300 °C/min (mantenimento 10 min) fino a 320°C a GC: 85 °C (mantenimento 0,5 min) fino a 150 °C a 6 °C/min fino a 180 °C a |
PTV: 120 °C fino a 165 °C a 300 °C/min (mantenimento 10 min) fino a 320 °C a 300 °C/min (mantenimento 8 min). GC: 120 °C (mantenimento 0,5 min) fino a 180 °C a 12 °C/min fino a 330 °C a 25 °C/min (mantenimento 5 min). |
La quantificazione è stata effettuata utilizzando il metodo di calibrazione standard interno deuterato utilizzando l’area degli ioni target acquisiti in modalità SIM (Single Ion Monitoring) per singolo quadrupolo o SRM (Selected Reaction Monitoring) per triplo quadrupolo. La Tabella II mostra gli ioni monitorati. Una curva di calibrazione ai minimi quadrati è stata utilizzata per calcolare i LOD strumentali utilizzando la formula LOD = 3,3*s y/k, dove k è una pendenza della curva di calibrazione e s y è l’errore standard del predicato valore y per ogni valore x; s y è stato ottenuto mediante una regressione lineare ai minimi quadrati.
Tabella II: Ioni acquisiti in modalità SIM monitorati con il metodo GC-MS e transizioni in modalità SRM monitorate con il metodo GC-MS/MS per tutti gli analiti.
| Composto | Ioni monitorati mediante MS (SIM) | Transizioni ioniche monitorate mediante MS/MS | |||
| Ione 1 | Ione 2 | Ione precursore (m/z) | Ione precursore (m/z) | Energia di collisione (V) | |
| 3-MCDP-d5 | 150 | 201 | 150 | 93 | 12 |
| 201 | 93 | 24 | |||
| 201 | 150 | 8 | |||
| 3-MCPD5 | 147 | 196 | 147 | 91 | 12 |
| 196 | 91 | 24 | |||
| 196 | 147 | 8 | |||
| 2-MCPD-d5 | 201 | 203 | 201 | 104 | 22 |
| 201 | 107 | 12 | |||
| 203 | 107 | 12 | |||
| 2-MCPD | 196 | 198 | 196 | 104 | 14 |
| 198 | 91 | 8 | |||
| 198 | 104 | 14 | |||
| 3-MBPD-d5 | 245 | 247 | N/D - I composti del MBPD sono un prodotto della preparazione dei campioni secondo il metodo AOCS Cd 29b-13 che non è avvenuta nello strumento MS/MS. | ||
| 3-MBPD | 240 | 242 | |||
Risultati e discussione
Nei casi in cui il tempo di analisi dello strumento è maggiore di quello necessario per la preparazione di un campione, la riduzione del tempo di analisi potrebbe comportare un incremento della produzione. Persino se la fase di preparazione dei campioni è più lunga del tempo di analisi dello strumento conviene comunque cercare dei modi per accorciare il tempo di corsa. La riduzione dei tempi di analisi consente di condizionare più a lungo la colonna tra le corse e comporta una potenziale diminuzione del consumo di gas grazie all’utilizzo di funzioni di risparmio di gas o cambiamenti di metodi per ridurre il flusso di gas tra un’analisi e l’altra.
Entrambi i metodi AOCS Cd 29b-13 e Cd 29c-13 seguono lo stesso programma di temperatura del GC e utilizzano il PTV in modalità splitless. La temperatura iniziale sia per il GC che per il PTV è pari a 85 °C, ma visto che l’intrappolamento del solvente non è necessario quando il primo analita eluisce a 13 minuti a una velocità della rampa del forno relativamente bassa, è stata considerata una temperatura dell’iniettore e del forno più elevata per determinare se il tempo di analisi potesse essere ridotto mediante programmi di temperatura dell’iniettore e del forno di durata minore senza sacrificare le prestazioni. In base al calcolo del vapore solvente relativamente all'isoottano e a un liner da 2 mm, la temperatura massima in modalità splitless è pari a 120 °C. Il campione utilizzato nell’esperimento è stato preparato fortificando il dipalmitato-3-MCPD nell’EVOO a un livello di 5 mg/kg. Al fine di trovare il punto di partenza migliore, consapevoli di voler prendere in considerazione temperature più elevate e di non dover necessariamente cominciare alla temperatura iniziale pubblicata pari a 85 °C, la temperatura del forno e quella dell’iniettore sono state aumentate con incrementi di 5 °C, da 95 °C a 120 °C. L’analisi è stata condotta sull’MS a singolo quadrupolo e i picchi ottenuti nella modalità SIM sono stati confrontati quanto ad ampiezza e risoluzione. Ai fini del confronto abbiamo sottoposto a test sia l’iniezione split che quella splitless.
Tabella III: Caratteristiche di picco del 3-MCPD derivatizzato con PBA a diverse temperature iniziali del forno e del PTV.
| Tecnica di iniezione | Temperatura iniziale iniettore e forno (°C) |
Tempo di ritenzione dei composti derivatizzati con PBA (min) |
Ampiezza del picco dei composti derivatizzati con PBA (min) |
Risoluzione | ||
| 3-MCPD-d5 | 3-MCPD | 3-MCPD-d5 | 3-MCPD | |||
| Splitless | 95 | 8,03 | 8,07 | 0,03 | 0,035 | 0,762 |
| 100 | 7,62 | 7,66 | 0,022 | 0,034 | 0,864 | |
| 105 | 7,22 | 7,26 | 0,023 | 0,021 | 1,126 | |
| 110 | 6,82 | 6,86 | 0,023 | 0,022 | 1,075 | |
| 115 | 6,42 | 6,46 | 0,025 | 0,025 | 0,944 | |
| 120 | 6,04 | 6,07 | 0,027 | 0,027 | 0,830 | |
| Split | 95 | 8,03 | 8,07 | 0,02 | 0,028 | 1,033 |
| 100 | 7,62 | 7,66 | 0,02 | 0,019 | 1,241 | |
| 105 | 7,22 | 7,26 | 0,021 | 0,019 | 1,209 | |
| 110 | 6,82 | 6,86 | 0,019 | 0,019 | 1,273 | |
| 115 | 6,43 | 6,47 | 0,019 | 0,019 | 1,242 | |
| 120 | 6,04 | 6,00 | 0,019 | 0,018 | 1,244 | |
Relativamente all’iniezione splitless, i picchi erano di forma stretta per entrambi i composti, in un range di 105-110 °C, mentre le ampiezze del picco sono rimaste praticamente invariate a temperature di 100 °C e superiori nella modalità split (Tabella III). Attraverso l’iniezione split si ottiene una buona forma del picco e sarebbe potenzialmente possibile ridurre la quantità di reagente di derivatizzazione sulla colonna; tuttavia, sorgerebbero naturalmente delle preoccupazioni su come raggiungere la sensibilità adeguata dato che l’iniezione split è considerata tradizionalmente come una tecnica per campioni a concentrazione più elevata.
Per valutare l’effetto sulla sensibilità abbiamo messo a confronto i limiti di rilevabilità (LOD) acquisiti a una temperatura iniziale di 110 °C e 120 °C per l’iniezione splitless e 120 °C per quella split. La Figura 3 mostra il confronto delle curve di calibrazione relative alle iniezioni split e splitless (normalizzato a una risposta standard interna). I LOD sono risultati pari a 0,14 mg/kg per l’iniezione splitless e 0,13 mg/kg per la modalità split. La tecnica di iniezione non ha effetto sulla pendenza o sui LOD: l’iniezione split offre le stesse prestazioni di un’iniezione splitless e viceversa. I picchi di forma più stretta prodotti nelle iniezioni split sono più alti, quindi la maggiore altezza del picco compensa la perdita nell'area del picco.
Figura 3: Confronto tra le curve di calibrazione delle iniezioni splitless e split dei 3-MCPD derivatizzati normalizzati alla risposta standard interna con 3-MCPD-d5 derivatizzati.
Dal confronto tra l’iniettore PTV a 120 °C e 280 °C e il normale iniettore split a 280 °C (Figura 4) non emergono neppure effetti sulle risposte del 3-MCPD; tuttavia, con un iniettore PTV è possibile contribuire ad aumentare la durata della colonna grazie alla possibilità di far fuoriuscire il PBA dopo il trasferimento degli analiti sulla colonna. L’utilizzo di una precolonna (per es. una precolonna Rxi da 5 m x 0,25 mm [cat. N° 10029] o una precolonna Rxi da 10 m x 0,25 mm [cat. N° 10059]) invece di un iniettore PTV è una valida alternativa.
Figura 4: Il confronto delle curve di calibrazione per l’iniezione split di 3-MCPD derivatizzati con iniettori e temperature diverse.
I limiti di rilevabilità sono risultati ampiamente al di sotto dei limiti suggeriti per il 3-MCPD e i glicidil esteri (rispettivamente 2 e 1 mg/kg). Tuttavia, i glicidil esteri stanno acquistando sempre più attenzione in particolare relativamente a formule per lattanti e alimenti per l’infanzia; pertanto potrebbe essere necessario un metodo più sensibile. Per questo motivo abbiamo optato per l’utilizzo del metodo GC-MS/MS (Figura 5), in base al quale il limite di rilevabilità strumentale è sceso a 0,02 mg/kg. In alternativa, il campione di calibrazione dal valore più basso (12 µg/kg) ha un rapporto segnale/rumore pari a 5:1 e potrebbe essere impiegato al posto di un limite di rilevabilità strumentale.
Figura 5: Risultati dell’analisi GC-MS/MS del glicil stearato.
Utilizzare software per esplorare ulteriori opportunità per l’ottimizzazione dei metodi
La versione online del software Restek Pro EZGC è uno strumento di selezione che si basa su una libreria precaricata di indici di ritenzione termodinamici e consente di prevedere i tempi di ritenzione e ottimizzare i metodi cromatografici senza dover analizzare serie di composti in svariate condizioni differenti. Il software Pro EZGC seleziona la fase stazionaria regolando contemporaneamente lo spessore del film, la temperatura, la lunghezza e il diametro interno della colonna, come pure il flusso. Gli utenti possono inserire ogni composto o copiare/incollare nel programma lunghi elenchi di composti.
Al fine di ottimizzare ulteriormente il metodo GC, abbiamo deciso di creare e utilizzare una nuova libreria Pro EZGC concentrando l’attenzione sul MCPD e sui glicidil esteri dopo l’idrolisi e la derivatizzazione. I glicidil esteri possono essere analizzati come 3-MCPD o 3-MBPD, entrambi presenti nel modello. Se decidete di eseguire delle analisi personalmente, ricordatevi sempre di impostare la pressione in uscita dalla colonna in “vuoto”, anziché pressione Atm!” La soluzione iniziale offerta dallo strumento Pro EZGC utilizza una rampa di temperatura e prevede l’eluizione dell’ultimo analita (3-MBPD) in poco più di 5 minuti utilizzando una colonna Rxi 17-Sil MS da 20 m x 0,18 mm x 0,18 µm. Tuttavia, desideravamo mantenere il programma di temperatura a due rampe, quindi siamo partiti usando un tool che ci ha dato i parametri di partenza—il Method Translator EZGC— e portato poi i parametri su un altro tool, Pro EZGC, per ottimizzarli. Abbiamo così ottenuto un nuovo programma di temperatura GC più veloce in grado di analizzare tutti gli analiti in meno di cinque minuti (Figura 6).
Figura 6: Confronto tra un cromatogramma modello Pro vGC e un cromatogramma reale per l’analisi veloce del MCPD.
Picchi: 1. 3-MCPD-d5 derivatizzato con PBA; 2. 3-MCPD derivatizzato con PBA; 3. 2-MCPD-d5 derivatizzato con PBA; 4. 2-MCPD derivatizzato con PBA; 5. 3-MBPD-d5 derivatizzato con PBA; e 6. 3-MBPD derivatizzato con PBA
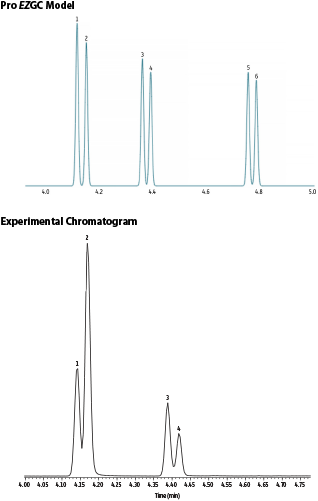
| Peaks | tR (min) | Conc. (ng/mL) |
|
|---|---|---|---|
| 1. | 3-MCPD-d5 PBA derivative | 4.143 | 100 |
| 2. | 3-MCPD PBA derivative | 4.169 | 200 |
| 3. | 2-MCPD-d5 PBA derivative | 4.388 | 100 |
| 4. | 2-MCPD PBA derivative | 4.418 | 100 |
| Column | Rxi-17Sil MS, 20 m, 0.18 mm ID, 0.18 µm (cat.# 14102) |
|---|---|
| Standard/Sample | See notes |
| Diluent: | Isooctane |
| Injection | |
| Inj. Vol.: | 1 µL PTV split (split ratio 10:1) |
| Liner: | Topaz 2.0 mm ID straight inlet liner w/wool (cat.# 23314) |
| Inlet Temp. Program: | 120 °C to 165 °C at 300 °C/min (hold 10 min) to 320 °C at 300 °C/min (hold 8 min) |
| Oven | |
| Oven Temp.: | 120 °C (hold 0.5 min) to 200 °C at 18.5 °C/min to 330 °C at 35 °C/min |
| Carrier Gas | He, constant flow |
| Flow Rate: | 1 mL/min |
| Detector | MS | |
|---|---|---|
| Mode: | SIM | |
| SIM Program: | 147, 150, 196, 201 m/z, 50 ms dwell | |
| Transfer Line Temp.: | 320 °C | |
| Analyzer Type: | Quadrupole | |
| Source Type: | Inert | |
| Source Temp.: | 230 °C | |
| Quad Temp.: | 150 °C | |
| Ionization Mode: | EI | |
| Instrument | Agilent 7890A GC & 5975C MSD | |
| Sample Preparation | Standards were derivatized with 20 µL phenylboronic acid (saturated solution in diethyl ether), dried, and then reconstituted in 1 mL isooctane. Final concentrations are given in the peak table. | |
| Notes | Compounds and retention times in the peak list are from the actual chromatographic analysis. PBA derivatives of 3-MBPD-d5 and 3-MBPD were included in the Pro EZGC model, but not in the experimental analysis. | |
Conclusioni
Abbiamo esaminato le strategie di ottimizzazione e sviluppato un metodo GC-MS indiretto e migliorato per l’analisi del 3-MCPD e dei glicidil esteri con cui abbiamo ottenuto migliori forme del picco senza effetti negativi sulla risoluzione. Il programma di temperatura ottimizzato empiricamente ha consentito una riduzione del tempo di analisi di 8 minuti, mentre con il metodo generato utilizzando il software del modellatore di cromatogrammi Pro EZGC è possibile risparmiare fino a 20 minuti. Utilizzando l’iniezione split anziché il metodo splitless non ha influito negativamente sui limiti di rilevabilità e offre il vantaggio di estendere potenzialmente la durata della colonna in quanto vi entra una quantità minore di reagente di derivatizzazione. Anche la scelta di un normale iniettore split/splitless al posto di un PTV non ha avuto effetti negativi sulle prestazioni; tuttavia è consigliabile l'utilizzo di una precolonna. Infine, l’utilizzo di un metodo GC-MS/MS ha comportato un miglioramento significativo dei limiti di rilevabilità.
Bibliografia
- World Health Organization, Joint FAO/WHO Expert Committee on Food Additives, November 2016. http://www.fao.org/3/a-bq821e.pdf
- A.P. Arisseto, W.C. Silva, R.G. Tivanello, K.A. Sampaio, E. Vicente, Recent advances in toxicity and analytical methods of monochloropropanediols and glycidyl fatty acid esters in food, Current Opinion in Food Science 24 (2018) 36-42. https://www.sciencedirect.com/science/article/abs/pii/S2214799318300675
- T.D. Haines, K.J. Adlaf, R.M. Pierceall, I. Lee, P. Venkitasubramanian, M.W. Collison, Direct determination of MCPD fatty acid esters and glycidyl fatty acid esters in vegetable oils by LC–TOFMS, J Am Oil Chem Soc 88(1) (2011) 1-14. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3022155/
- European Food Safety Authority, Revised safe intake for 3-MCPD in vegetable oils and food, 10 January 2018. https://www.efsa.europa.eu/en/press/news/180110
- EU considers maximum limits for 3-MCPD and 3-MPDEs in oils and fats, Oils & Fats International, 23 July 2019. https://www.ofimagazine.com/news/eu-considers-maximum-limits-for-3-mcpd-and-3-mpdes-in-oils-and-fats

