Trennen Sie eine Vielzahl von polaren Analyten mit einer neuartigen stationären Hybridphase
- Ohne zeitaufwendige Derivatisierung oder Ionenpaarreagenz.
- Wechseln Sie zwischen Retentionsmodi durch einfache Änderungen der mobilen Phase und kurze Äquilibrierungszeiten.
- Ideal für die Erhöhung der Empfindlichkeit und Selektivität bei LC-MS-Analysen.
Vereinfachen Sie die Analyse von polaren Verbindungen
Die Analyse polarer Verbindungen mithilfe der Flüssigkeitschromatografie war in der Vergangenheit stets eine Herausforderung. Mangelnde Retention und schlechte Peakformen, komplexe mobile Phasen, die vielleicht nicht MS-verträglich sind, lange Äquilibrierungszeiten, geringe Empfindlichkeit und die Derivatisierung der Proben sind allesamt Komplikationen, die die Effizienz und Produktivität der Laboratorien beeinträchtigen. Durch die Entwicklung einer neuartigen Säule, speziell konzipiert für die Analyse einer Vielzahl von polaren Verbindungen, können Wissenschaftler diese Probleme nun jedoch vermeiden, indem sie sich die wahre Kraft der Chromatografie zu Nutze machen.
Die wahre Kraft der Chromatografie nutzen
Einer der wichtigsten, aber am wenigsten verstandenen Aspekte der Leistungsfähigkeit einer Methode ist die Verwendung der korrekten stationären Phase für eine bestimmte Trennung. Für die Analyse polarer Verbindungen bieten Reversed-Phase-Säulen keine ausreichende Retention ohne Einsatz komplexer mobiler Phasen oder Probenderivatisierung, um so die fehlenden effektiven Wechselwirkungen zwischen den Analyten und der Säule zu kompensieren. Werden die Zielanalyten jedoch mit einer stationären Phase mit zweckbestimmtem Auflösungsvermögen gepaart, können Sie aufwendige Verfahren zu Probenvorbereitung vermeiden, Zeit und Kosten sparen und mögliche Fehlerquellen reduzieren.
Die stationäre Phase der Raptor Polar X wurde speziell entwickelt, um polare Analyten durch ein Zusammenspiel von zwei Retentionsmechanismen selektiv zu retardieren. Diese spezielle Hybridphase ist ideal für die Analyse einer Vielzahl polarer Analyten, besonders in Verbindung mit Massenspektrometrie. Vereinfachen Sie die Analyse polarer Verbindungen mit dem Auflösungsvermögen der Raptor Polar X Säulen von Restek.
Mehr als die Summe ihrer Teile
Die bei der Analyse von polaren Verbindungen am häufigsten verwendeten Retentionsmechanismen sind die hydrophile Interaktionsflüssigchromatografie (HILIC) und der Ionenaustausch. Darauf aufbauend hat Restek eine neuartige stationäre Phase entwickelt, die diese beiden Modi in einem einzigen Liganden vereint. Da dieser spezielle Ligand an oberflächlich poröse Partikel (auch „Superficially Porous Particles“ oder SPP genannt) gebunden ist, lässt sich mit Raptor Polar X Säulen eine Vielzahl polarer Analyten zuverlässig retardieren und effizient trennen.
Bei typischen anwendungsspezifischen Säulen überwiegt einer der beiden Retentionsmodi und die bei der Retention einer bestimmten polaren Verbindung erzielten Vorteile gehen zu Kosten der Trennleistung für andere Analyten. Im Gegensatz dazu sind bei der Raptor Polar X Säule mit ihrer zum Patent angemeldeten Phasenchemie zwei unabhängige Retentionsmechanismen verfügbar, wodurch sich eine wirklich ausgewogene und flexible Retention erzielen lässt (Abbildung 1). Mithilfe einfacher Änderungen der mobilen Phase können Analytiker zwischen den beiden Modi wechseln und die Retention der Zielsubstanzen selektiv justieren, ohne lange Äquilibrierungszeiten vor oder zwischen verschiedenen Proben zu benötigen.
Abbildung 1: Durch einfache Änderungen der mobilen Phase lässt sich die Raptor Polar X Säule schnell und einfach zwischen den verschiedenen polaren Retentionsmodi wechseln. Dadurch entsteht die beispiellose Möglichkeit, eine Vielzahl polarer Verbindungen zu retardieren und trennen, selbst innerhalb des selben Analyselaufs.
Und so funktioniert‘s: Wechseln des Retentionsmodus
Bei Verwendung einer mobilen Phase mit einem relativ hohen Anteil von Acetonitril zu Wasser bildet sich an der Kieselgeloberfläche eine Wasserschicht, in der sich polare Verbindungen verteilen können. Die Verteilung in der wässrigen Schicht führt zu effektiven Wechselwirkungen zwischen polaren Analyten und dem an der Kieselgeloberfläche gebundenen Liganden (Abbildung 2). Die neuartige Ligandenchemie der Raptor Polar X Säule vereinfacht diese Methode weiter und ermöglicht eine schnellere Äquilibrierung und Neuäquilibrierung der Säule als je zuvor. Das heißt, neue Säulen sind schnell betriebsbereit und der Probendurchsatz lässt sich wegen der kürzeren Äquilibrierungszeiten zwischen verschiedenen Proben steigern.
Abbildung 2: Die schnelle Bildung einer Wasserschicht an der Kieselgeloberfläche ermöglicht die Verteilung einer Vielzahl von polaren Analyten zwischen dem Acetonitril der mobilen Phase und der wässrigen Schicht. Diese Verteilung, zusammen mit den Wechselwirkungen mit der stationären Phase, definiert den HILIC-Retentionsmechanismus.
Für kleinere polare Verbindungen erzeugen diese Bedingungen mit einem hohen Anteil an Acetonitril starke Wechselwirkungen zwischen den Analyten und der stationären Phase, so dass kleine, hochpolare geladene Verbindungen retardiert werden. Zur Feinjustierung der Retention wird einfach der Anteil des Wassers in der mobilen Phase erhöht. Dadurch werden die geladenen polaren Verbindungen in die mobile Phase überführt und effektiv eluiert. Bei Verwendung einer mobilen Phase mit höherem Wasseranteil wird die durch HILIC-Verteilung bedingte Retention reduziert und das Ionenaustauschverhalten der stationären Phase wird zum vorherrschenden Retentionsmechanismus (Abbildung 3).
Abbildung 3: Bei einer mobilen Phase mit hohem Wasseranteil wird der Ionenaustauschmechanismus zum vorherrschenden Retentionsmodus bei der Analyse polarer Verbindungen.
Wechsel des Retentionsmodus: Ein Beispiel
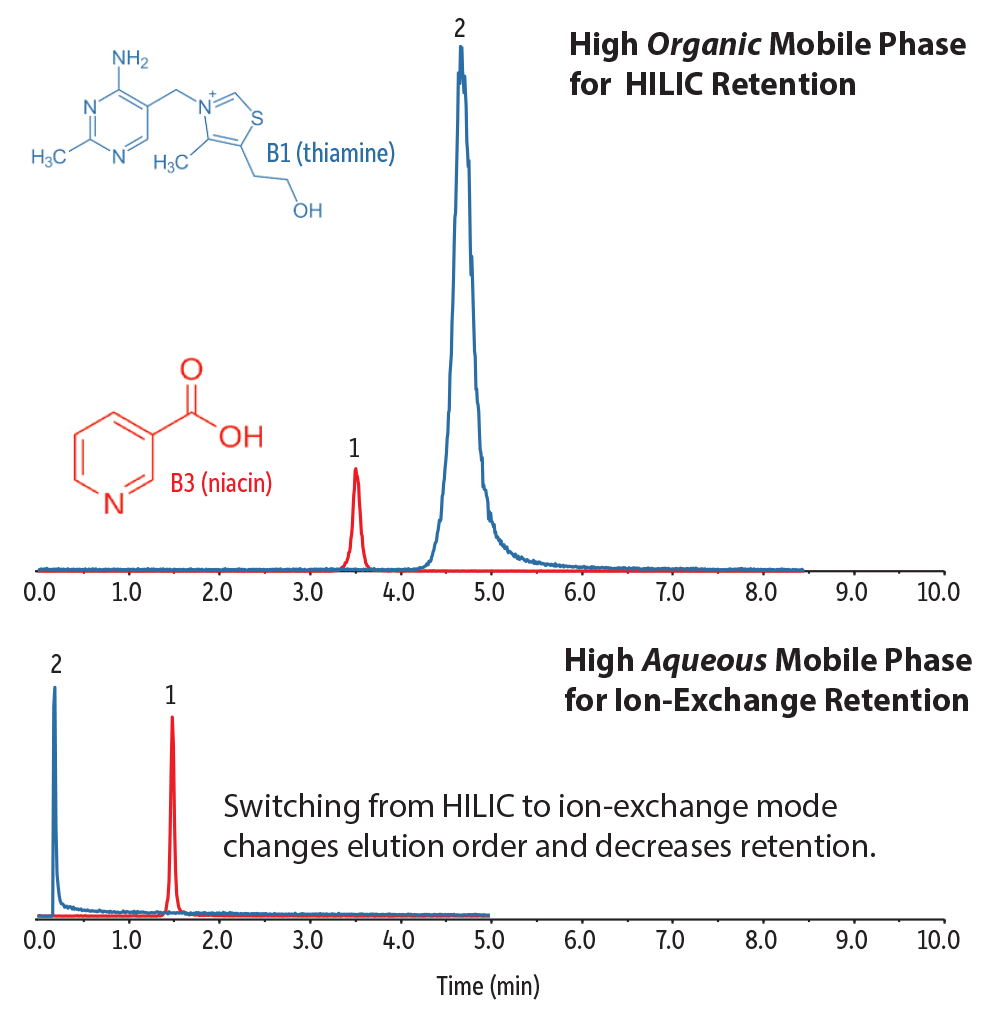
Zur Veranschaulichung dieser Prinzipien ist in Abbildung 4 dargestellt, wie zwei verschiedene Typen von polaren Verbindungen mit der stationären Phase in Wechselwirkung treten und wie ihr Retentionsverhalten durch einfache Änderungen der mobilen Phase beeinflusst wird. In diesem Beispiel analysierten wir zwei wasserlösliche Vitamine: Vitamin B3 (Niacin), eine organische Säure, und Vitamin B1 (Thiamin), das eine permanente positive Ladung trägt.
Im oberen Chromatogramm wurde eine mobile Phase mit hohem organischen Anteil verwendet, d.h. Bedingungen, die HILIC-Trennungen begünstigen. Bei Verwendung der Raptor Polar X Säule unter diesen Bedingungen bildet sich auf der Oberfläche der Kieselgelpartikel schnell einer Wasserschicht. Polare Verbindungen können sich dann zwischen der Acetonitrilschicht und der Wasserschicht verteilen, wo sie auch mit der Kieselgeloberfläche und der stationären Phase in Wechselwirkung treten können. Auf diese Weise werden polare Verbindungen durch hydrophile Wechselwirkungen mit der stationären Phase retardiert und dennoch durch eine mobile Phase mit hohem organischen Anteil eluiert. Das begünstigt die LC-MS/MS-Analyse aufgrund der besseren Desolvatisierung und der erhöhten Ionisationseffizienz.
Das untere Chromatogramm illustriert die chromatografischen Änderungen, die auftreten, wenn der Retentionsmechanismus durch Verwendung einer mobilen Phase mit höherem Wasseranteil gewechselt wird. Bei zunehmender Entfernung von den idealen HILIC-Bedingungen werden sowohl Vitamin B1 als auch Vitamin B3 weniger retardiert. Der Grund dafür ist die zunehmende Bedeutung des Ionenaustausch-Retentionsverhaltens und die gleichzeitige Abnahme der HILIC-Retention, wenn der Wasseranteil der mobilen Phase zunimmt. Außerdem ändert sich die Elutionsreihenfolge, weil Vitamin B1 unter Ionenaustauschbedingungen weniger retardiert wird als Vitamin B3.
Abbildung 4: Einfache Änderungen der einfach herzustellenden, MS-verträglichen mobilen Phasen können die unterschiedlichen Retentionsmechanismen der neuartigen Raptor Polar X Phasenchemie entweder begünstigen oder unterdrücken.
| Peaks | |
|---|---|
| 1. | Vitamin B3 |
| 2. | Vitamin B1 |
| Column | Raptor Polar X (cat.# 9311A52) |
|---|---|
| Dimensions: | 50 mm x 2.1 mm ID |
| Particle Size: | 2.7 µm |
| Temp.: | 30 °C |
| Standard/Sample | |
| Diluent: | 0.1% Formic acid in acetonitrile |
| Mobile Phase | |
| Flow: | 0.5 mL/min |
| Detector | MS/MS |
|---|---|
| Ion Source: | Electrospray |
| Ion Mode: | ESI+ |
| Instrument | HPLC |
| Notes | Mobile phase A: Water, 5 mM ammonium formate, 0.1% formic acid Mobile phase B: Acetonitrile, 0.1% formic acid Top chromatogram: 95% B, 10 min run, 2 μL injection (100 ppm B3, 0.01 ppm B1) Bottom chromatogram: 60% B, 5 min run, 0.5 μL injection (100 ppm B3, 0.1 ppm B1) |
Ausgewogene Hybridretention ermöglicht Analyse mehrerer Verbindungen mit einer einzigen Methode
Säulen sind üblicherweise spezialisiert: und zwar auf eine einzige Art von Wechselwirkung unter Ausschluss anderer. Dieser Ansatz hat sich bewährt, wenn die Zielanalyten identische Eigenschaften besitzen. Polare Verbindungen zeigen jedoch erhebliche Variation in ihren chemischen Eigenschaften. Für die Analyse von polaren Verbindungen bedeutet dies häufig die Verwendung mehrerer Methoden mit verschiedenen Säulen oder Bedingungen für jeden Verbindungstyp. Wie anhand der nachfolgenden Beispiele gezeigt, ist die Hybridphasenchemie der Raptor Polar X Säulen eine bessere Alternative, weil das Multimode-Retentionsprofil die Analyse einer Vielzahl von Zielanalyten mit derselben Methode gestattet.
QuPPe-inspirierte Liste polarer Verunreinigungen
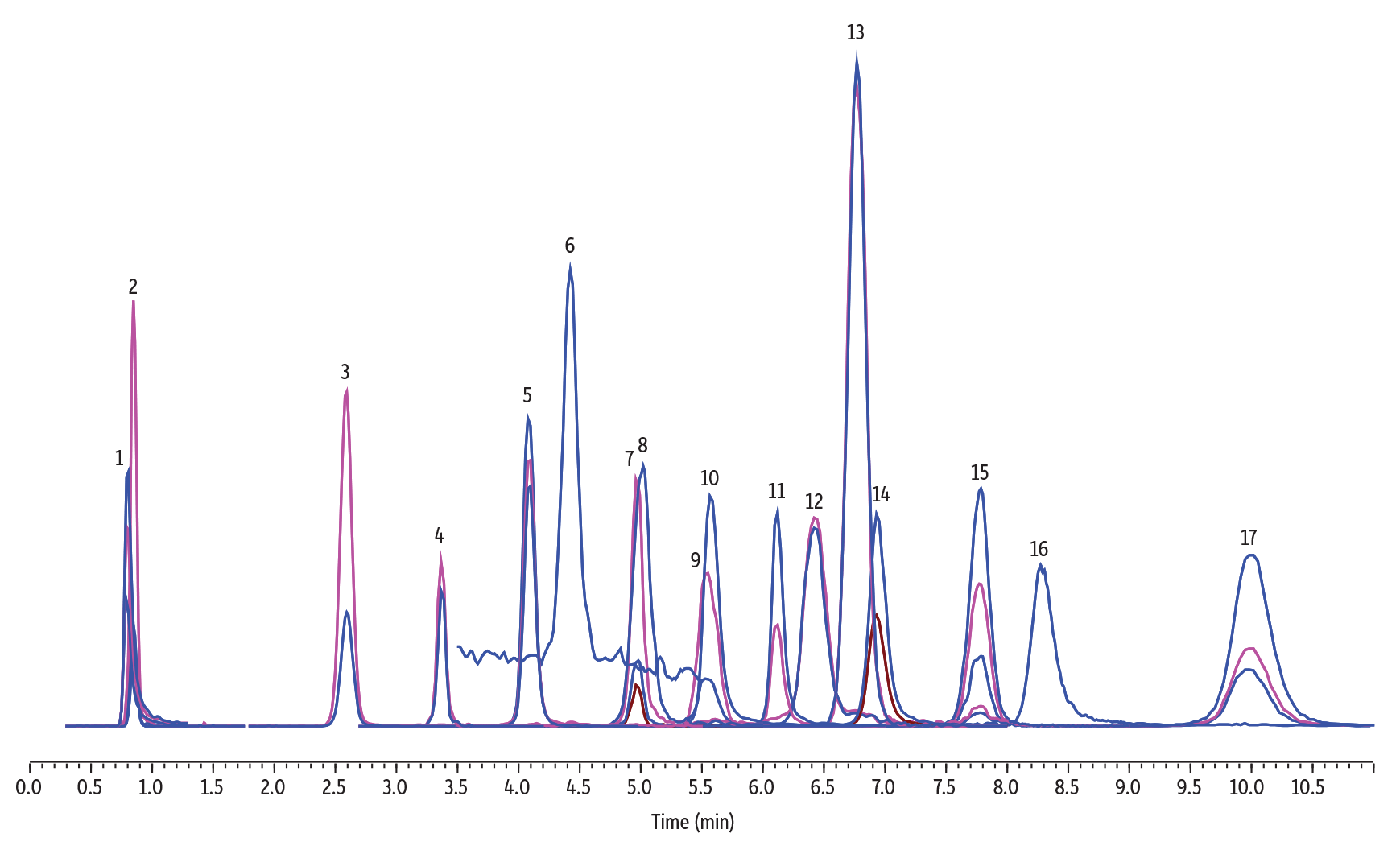
Die europäische Quick Polar Pesticides (QuPPe)-Methode umfasst eine Reihe von polaren Analyten aus anionischen polaren Herbiziden wie Glyphosat und verwandten Verbindungen bis hin zu einer Vielzahl von Oxychlor-Verunreinigungen, darunter Chlorat und Perchlorat. Wie in Abbildung 5 gezeigt, kann die Raptor Polar X Säule dieses diverse Gemisch retardieren und schnell trennen, wobei die letzte Verbindung nach etwa 10.5 Minuten eluiert und die Analyse insgesamt nur 13 Minuten dauert. Diese Trennung wird mit einfachen ungepufferten mobilen Phasen durchgeführt, die mit 0,5% Ameisensäure angesäuert werden, um Peakverbreiterung und Peaktailing zu reduzieren. Die in Abbildung 5 gezeigte Methode konnte auch Verbindungen mit ähnlichen Massenfragmenten trennen, wie etwa AMPA von N-Acetyl-AMPA und Fosetyl-Aluminium von Phosphonsäure und Phosphorsäure (eine häufig beobachtete Matrixkomponente und Störquelle).
Abbildung 5: In dieser Analyse polarer Verbindungen lässt sich eine diverse Gruppe von Analyten dank der ausgewogenen Retentionseigenschaften der Raptor Polar X Säule in einem einzigen Lauf erfolgreich trennen.
| Peaks | tR (min) | Conc. (ng/mL) | Precursor Ion | Product Ion 1 | Product Ion 2 | Product Ion 3 | Precursor 2 | Product Ion 2 | |
|---|---|---|---|---|---|---|---|---|---|
| 1. | Aminomethylphosphonic acid (AMPA) | 0.805 | 200 | 110.1 | 79.1 | 63.1 | 81.1 | - | - |
| 2. | Bialophos | 0.847 | 100 | 322.2 | 88.2 | 216.1 | 134.2 | - | - |
| 3. | Perchlorate | 2.593 | 5 | 101.0 | 84.95 | - | - | 98.9 | 83 |
| 4. | Glufosinate | 3.376 | 200 | 180.2 | 85.2 | 95.1 | - | - | - |
| 5. | 3-(Methylphophinico) propionic acid (MPPA) | 4.076 | 100 | 151.0 | 63.0 | 107.1 | 133.2 | - | - |
| 6. | Trifluoracetic acid (TFA) | 4.423 | 20 | 113.0 | 69.1 | 19.1 | - | - | - |
| 7. | 2-Hydroxyethane phosphonic acid (HEPA) | 4.969 | 100 | 125.1 | 79.0 | 95.0 | 63 | - | - |
| 8. | Difluoroacetic acid (DFA) | 5.018 | 200 | 95.0 | 51.1 | - | - | - | - |
| 9. | Chlorate | 5.542 | 100 | 85.0 | 69.0 | - | - | 83.0 | 67.1 |
| 10. | Ethephon | 5.564 | 200 | 143.1 | 107.2 | - | - | - | |
| 11. | Glyphosate | 6.113 | 200 | 168.1 | 63.1 | 79.1 | - | - | - |
| 12. | Bromide | 6.423 | 2000 | 80.9 | 80.9 | - | - | 79.0 | 79.0 |
| 13. | Bromate | 6.771 | 600 | 129.0 | 113 | - | - | 127 | 111.1 |
| 14. | N-acetyl AMPA | 6.932 | 200 | 152.1 | 110.1 | 62.9 | - | - | - |
| 15. | Fosetyl aluminum | 7.775 | 80 | 109.1 | 81.0 | 63.0 | 78.9 | - | - |
| 16. | Phosphonic acid | 8.275 | 500 | 81.1 | 62.9 | - | - | - | - |
| 17. | N-acetyl glufosinate | 9.980 | 200 | 222.2 | 136.1 | 134.1 | 59.0 | - | - |
| Column | Raptor Polar X (cat.# 9311A32) | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 30 mm x 2.1 mm ID | ||||||||||||||||||||||||
| Particle Size: | 2.7 µm | ||||||||||||||||||||||||
| Pore Size: | 90 Å | ||||||||||||||||||||||||
| Temp.: | 35 °C | ||||||||||||||||||||||||
| Standard/Sample | |||||||||||||||||||||||||
| Diluent: | Water | ||||||||||||||||||||||||
| Inj. Vol.: | 1 µL | ||||||||||||||||||||||||
| Mobile Phase | |||||||||||||||||||||||||
| A: | Water, 0.5% formic acid | ||||||||||||||||||||||||
| B: | Acetonitrile, 0.5% formic acid | ||||||||||||||||||||||||
|
| Detector | MS/MS |
|---|---|
| Ion Mode: | ESI- |
| Mode: | MRM |
| Instrument | UHPLC |
Zusätzlich zu der von Restek entwickelten Methode, die in Abbildung 5 dargestellt ist, wurden die Raptor Polar X Analyse- und Vorsäulen unabhängig evaluiert und in die QuPPe-Methode selbst aufgenommen [1]. Sie werden in einer Methode für den Nachweis einer Vielzahl von polaren Pestiziden mittels LC-MS/MS im negativen ESI-Modus verwendet.
Underivatisierte Aminosäuren
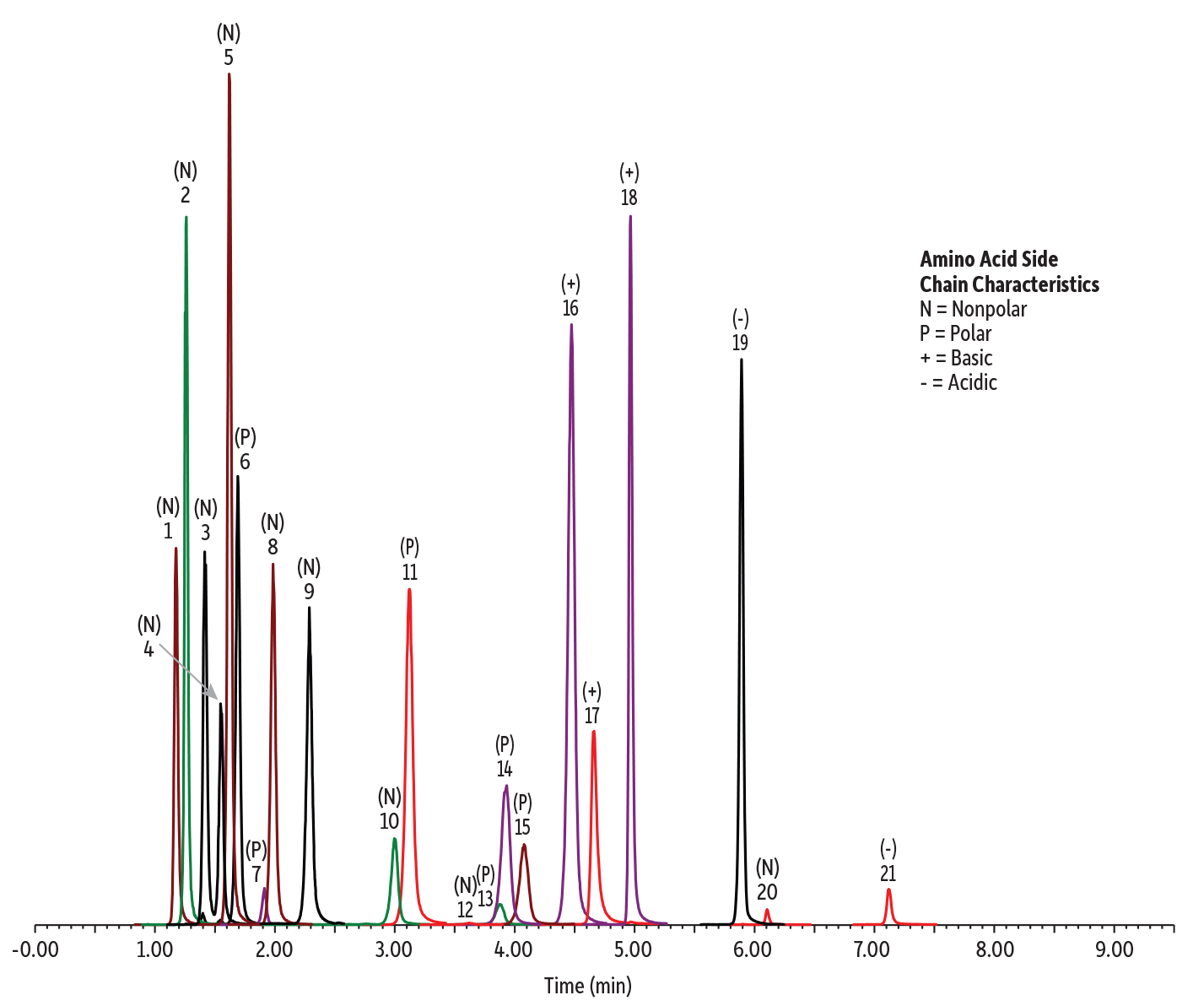
Aminosäuren sind eine diverse Gruppe hochpolarer Verbindungen, die üblicherweise mittels Reversed-Phase- oder Ionenaustausch-Chromatografie unter Verwendung von Vor- oder Nachsäulenderivatisierung analysiert werden. Direkte Analyse von underivatisierten Aminosäuren ist aufgrund der geringen Retention und schlechten chromatografischen Performance schwierig. Auf einer Raptor Polar X Säule werden underivatisierte Aminosäuren mit nichtpolaren, polaren, positiv oder negativ geladenen Seitenketten jedoch retardiert und lassen sich mit einer einzigen Methode leicht trennen. Abbildung 6 zeigt die Analyse von 21 Aminosäuren, darunter ein Taurin-Nahrungsergänzungsmittel, in einer Matrix flüssiger Babynahrung nach einfacher Proteinausfällung und Verwendung des resultierenden Extrakts.
Abbildung 6: Verbindungen mit unterschiedlichen Polaritäten, wie diese Aminosäuren, können mit derselben Methode auf einer Raptor Polar X Säule analysiert werden.
.
| Peaks | tR (min) | Precursor Ion | Product Ion | |
|---|---|---|---|---|
| 1. | Tryptophan | 1.17 | 205.07 | 146.08 |
| 2. | Phenylalanine | 1.26 | 166.13 | 120.10 |
| 3. | Leucine | 1.41 | 132.13 | 86.10 |
| 4. | Isoleucine | 1.55 | 132.13 | 86.10 |
| 5. | Methionine | 1.62 | 150.07 | 104.10 |
| 6. | Tyrosine | 1.69 | 182.10 | 136.08 |
| 7. | Taurine | 1.91 | 126.07 | 108.07 |
| 8. | Valine | 1.98 | 118.13 | 72.11 |
| 9. | Proline | 2.29 | 116.13 | 70.09 |
| 10. | Alanine | 3.00 | 90.03 | 44.10 |
| Peaks | tR (min) | Precursor Ion | Product Ion | |
|---|---|---|---|---|
| 11. | Threonine | 3.12 | 120.13 | 74.08 |
| 12. | Glycine | 3.62 | 76.10 | 30.11 |
| 13. | Glutamine | 3.87 | 147.13 | 84.07 |
| 14. | Serine | 3.93 | 106.07 | 60.09 |
| 15. | Asparagine | 4.08 | 133.13 | 74.07 |
| 16. | Arginine | 4.47 | 175.17 | 70.09 |
| 17. | Histidine | 4.66 | 156.07 | 110.16 |
| 18. | Lysine | 4.97 | 147.13 | 84.13 |
| 19. | Glutamic acid | 5.89 | 148.10 | 84.10 |
| 20. | Cystine | 6.10 | 241.13 | 152.00 |
| 21. | Aspartic acid | 7.12 | 134.07 | 74.06 |
| Column | Raptor Polar X (cat.# 9311A12) | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 100 mm x 2.1 mm ID | ||||||||||||||||||||||||
| Particle Size: | 2.7 µm | ||||||||||||||||||||||||
| Temp.: | 30 °C | ||||||||||||||||||||||||
| Standard/Sample | |||||||||||||||||||||||||
| Diluent: | 20:80 Water:acetonitrile, 0.01 N HCl | ||||||||||||||||||||||||
| Conc.: | Endogenous amino acids | ||||||||||||||||||||||||
| Inj. Vol.: | 5 µL | ||||||||||||||||||||||||
| Mobile Phase | |||||||||||||||||||||||||
| A: | Water, 0.5% formic acid | ||||||||||||||||||||||||
| B: | Mobile Phase B: 9:1 Acetonitrile:20 mM ammonium formate in water (pH 3.0) (The ammonium formate concentration is 20 mM relative to the total volume of mobile phase B. See preparation notes for instructions on diluting a 200 mM aqueous starting solution.) | ||||||||||||||||||||||||
|
| Detector | MS/MS |
|---|---|
| Ion Mode: | ESI+ |
| Mode: | MRM |
| Instrument | UHPLC |
| Sample Preparation | A 200 µL aliquot of protein hydrolysate formula (Similac ALIMENTUM) was mixed with 800 µL of acetonitrile and 10 µL of 1 N HCl. After centrifugation at 4000 rpm for 5 minutes, the supernatant was diluted 20-fold with 20:80 water:acetonitrile (0.01 N HCl) and injected for analysis. |
| Notes | Mobile Phase B Preparation: To make 500 mL of mobile phase B, measure ~45 mL of water into a small beaker and add 1 mL of 10 M ammonium formate solution. Adjust pH to 3.0 by adding formic acid and then bring the volume to 50 mL with water. Combine this 50 mL ammonium formate solution (pH 3.0) with 450 mL of acetonitrile to complete the preparation. |
Ultrakurzkettige bis langkettige PFAS
Das abschließende Beispiel der Fähigkeit der Raptor Polar X Säule, die Produktivität einer Methode zu maximieren, ist eine Applikation, die den Weg für zukünftige Testverfahren ebnet. Aktuelle LC-MS/MS-Methoden der Analyse per- und polyfluorierter Alkylverbindungen (PFAS) befassen sich in erster Linie mit kurzkettigen (C4-C6), langkettigen (C8 und höher) sowie alternativen Verbindungen, berücksichtigen jedoch nicht die neuen ultrakurzkettigen (C2 und C3) Verbindungen. Typische Reversed-Phase-Methoden für die PFAS-Analyse haben zu wenig Retention für ultrakurzkettige PFAS, während andere, auf Ionenaustausch basierende Methoden, zu viel Retention aufweisen, was eine schlechte chromatografische Performance zur Folge hat. Mit der Raptor Polar X Säule lassen sich aufgrund des ausgewogenen Retentionsverhaltens sowohl ultrakurzkettige als auch langkettige PFAS in einem einzigen isokratischen HPLC-Lauf innerhalb von 5 Minuten analysieren (Abbildung 7).
Abbildung 7: Ultrakurzkettige, traditionelle und alternative PFAS lassen sich mit einer einzigen Methode auf der neuartigen stationären Phase Raptor Polar X analysieren.
Passivierung – Ja oder nein?
Die Analyse von Glyphosat im Spurenbereich kann sich schwierig gestalten, da es mit aktiven Metallzentren in einem LC-System Chelate bilden kann. Obwohl die Raptor Polar X Säule einen behandelten Probenflussweg besitzt und gebrauchs¬fertig geliefert wird, kann eine Passivierung der Metallkomponenten im Proben¬flussweg Ihres LC-Geräts hilfreich sein. Ob eine Passivierung erforderlich ist oder nicht, hängt von der jeweiligen Applikation und Ihrer spezifischen Gerätekon-figuration ab. Für die Analyse von polaren Verbindungen, die bekanntermaßen Chelate bilden, wie z. B. Glyphosat, empfiehlt Restek eine Behandlung Ihres Systems mit LC-Passivierungslösung (Art.-Nr. 32475) vor dem Probenlauf.
Eine neuartige stationäre Phase basierend auf der bewährten Raptor Qualität
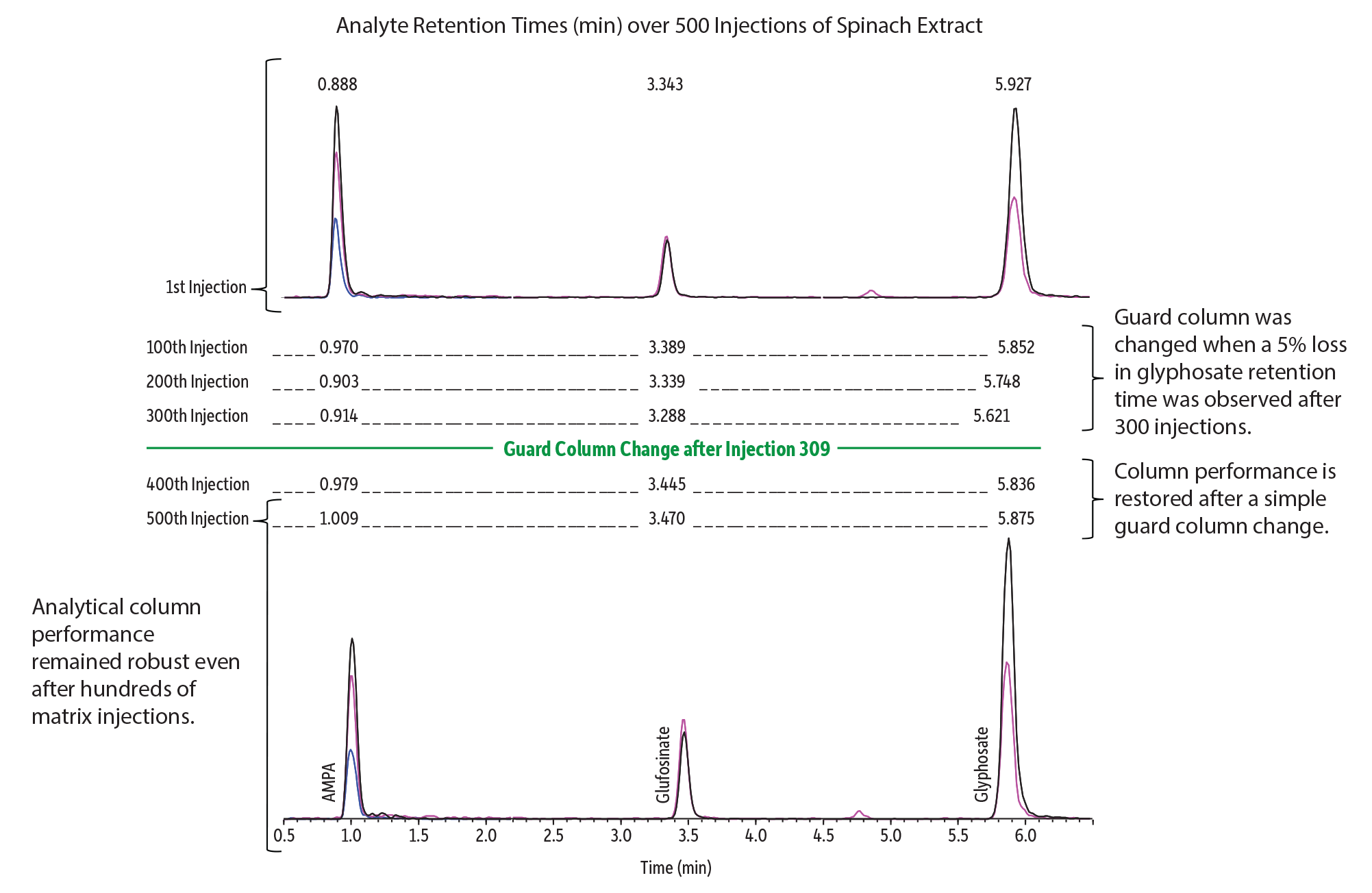
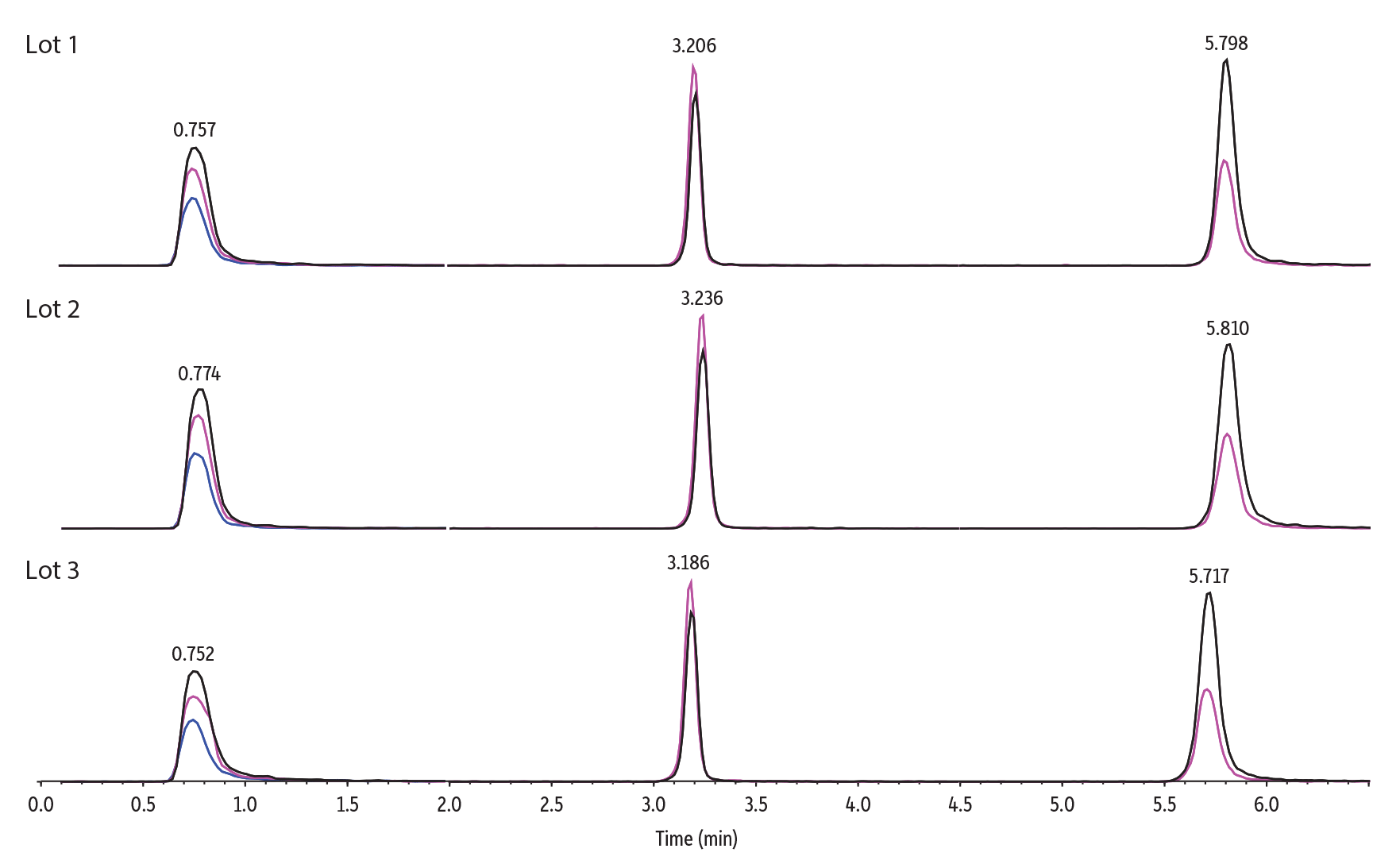
Raptor Polar X wurde nach denselben anspruchsvollen Vorgaben entwickelt, gefertigt und geprüft, die Raptor Säulen zu einem Synonym für Qualität gemacht haben. Egal ob es um die robuste Performance von Injektion-zu-Injektion bei der Analyse von reellen Proben in schwierigen Matrizes wie Spinat (Abbildung 8) oder um die zuverlässige Leistungsfähigkeit von Säule-zu-Säule bis zum letztendlichen Austausch der Säule (Abbildung 9) geht – Sie können sich auf die Qualität der Marke Raptor verlassen. Außerdem gewährleistet die Funktionalität der Hybridretention der Raptor Polar X Säule unter Verwendung eines einzigen Liganden die gleichbleibende Fertigungsqualität aller Säulen, die sogar aggressiven Bedingungen wie Injektionen großer Wasservolumina ohne Verlust der stationären Phase standhalten können.
Abbildung 8: Sehr gute Peakformen und hervorragende Stabilität der Retentionszeiten nach hunderten von Injektionen eines Spinatextrakts veranschaulichen die robuste Performance der Raptor Polar X Säulen für die Analyse polarer Verbindungen.
| Peaks | Conc. (ng/mL) | Precursor Ion | Product Ion 1 | Product Ion 2 | Product Ion 3 | |
|---|---|---|---|---|---|---|
| 1. | AMPA | 100 | 110.10 | 79.05 | 63.10 | 81.10 |
| 2. | Glufosinate | 100 | 180.20 | 85.15 | 95.10 | - |
| 3. | Glyphosate | 100 | 168.10 | 63.05 | 79.05 | - |
| Column | Raptor Polar X (cat.# 9311A32) | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 30 mm x 2.1 mm ID | ||||||||||||||||||||||||
| Particle Size: | 2.7 µm | ||||||||||||||||||||||||
| Pore Size: | 90 Å | ||||||||||||||||||||||||
| Guard Column: | Raptor Polar X guard column cartridge 5 mm, 2.1 mm ID, 2.7 µm (cat.# 9311A0252) | ||||||||||||||||||||||||
| Temp.: | 35 °C | ||||||||||||||||||||||||
| Standard/Sample | Spinach extract | ||||||||||||||||||||||||
| Inj. Vol.: | 2 µL | ||||||||||||||||||||||||
| Mobile Phase | |||||||||||||||||||||||||
| A: | Water, 0.5% formic acid | ||||||||||||||||||||||||
| B: | Acetonitrile, 0.5% formic acid | ||||||||||||||||||||||||
|
| Detector | MS/MS |
|---|---|
| Ion Mode: | ESI- |
| Mode: | MRM |
| Instrument | UHPLC |
| Sample Preparation | Frozen spinach was added to a Blixer processor with dry ice (3:1-4:1 ratio) and then ground into a very fine powder. The homogenate was placed into the freezer immediately. A 5.0 gram sample of the spinach powder was weighed into a 50 mL centrifuge tube (cat.# 25846). According to the QuPPe method (Quick Polar Pesticides Method), 5.0 mL of methanol with 1.0% formic acid was added into the centrifuge tube. The tube was shaken by hand for 1 min and then by a mechanical shaker vigorously for 5 min. After centrifuging for 10 min at 4200 rpm, the supernatant was filtered through a 0.22 μm filter (cat.# 23984). The final extract was fortified with the AMPA, glufosinate, and glyphosate at a final concentration of 100 ng/mL. |
Abbildung 9: Raptor Polar X Säulen gewährleisten zuverlässige Reproduzierbarkeit von Lot zu Lot.
| Peaks | Conc. (ng/mL) | Precursor Ion | Product Ion 1 | Product Ion 2 | Product Ion 3 | |
|---|---|---|---|---|---|---|
| 1. | AMPA | 100 | 110.10 | 79.05 | 63.10 | 81.10 |
| 2. | Glufosinate | 100 | 180.20 | 85.15 | 95.10 | - |
| 3. | Glyphosate | 100 | 168.10 | 63.05 | 79.05 | - |
| Column | Raptor Polar X (cat.# 9311A32) | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 30 mm x 2.1 mm ID | ||||||||||||||||||||||||
| Particle Size: | 2.7 µm | ||||||||||||||||||||||||
| Pore Size: | 90 Å | ||||||||||||||||||||||||
| Temp.: | 35 °C | ||||||||||||||||||||||||
| Standard/Sample | |||||||||||||||||||||||||
| Diluent: | Water | ||||||||||||||||||||||||
| Inj. Vol.: | 5 µL | ||||||||||||||||||||||||
| Mobile Phase | |||||||||||||||||||||||||
| A: | Water, 0.5% formic acid | ||||||||||||||||||||||||
| B: | Acetonitrile, 0.5% formic acid | ||||||||||||||||||||||||
|
| Detector | MS/MS |
|---|---|
| Ion Mode: | ESI- |
| Mode: | MRM |
| Instrument | UHPLC |
Raptor Polar X Säulen: Revolutionierung der LC-Analyse polarer Verbindungen
Geringe Retention, schwache Response, komplexe Verfahren zur Probenvorbereitung ... die Analyse polarer Verbindungen war in der Vergangenheit oft mit großen Problemen bezüglich Datenqualität und Laborproduktivität behaftet. Jetzt lässt sich die Analyse dieser anspruchsvollen und vielfältigen Verbindungen mithilfe der Raptor Polar X Säulen mit ihrer neuartigen Phasenchemie wesentlich einfacher durchführen, indem die Retention per HILIC und Ionenaustausch an einem einzigen Liganden kombiniert wird. Durch Bindung dieses speziellen Liganden an Core-Shell-Partikel (SPP) hat Restek eine Phase geschaffen, die eine Vielzahl polarer Verbindungen retardiert und effizient trennt. Die durch diese Merkmale erzeugte Synergie bietet die beispiellose Fähigkeit zur Analyse einer Vielzahl polarer Verbindungen und stellt LC-Analytikern in vielen Industriezweigen ein leistungsstarkes, produktives und flexibles Werkzeug zur Verfügung.
Literatur
- M. Anastassiades, A.-K. Wachtler, D. I. Kolberg, E. Eichhorn, H. Marks, A. Benkenstein, S. Zechmann; D. Mack, C. Wildgrube, A. Barth, I. Sigalov, S. Görlich, D. Dörk, G. Cerchia, Quick method for the analysis of highly polar pesticides in food involving extraction with acidified methanol and LC - or ICMS/MS Measurement - I. Food of Plant Origin (QuPPe-PO-Method)–Version 12 (published on EURL-SRM website on July 23, 2021). https://www.eurl-pesticides.eu/docs/public/tmplt_article.asp?LabID=200&CntID=1115&Theme_ID=1&Pdf=False&Lang=EN

