Une nouvelle approche pour l’analyse des PFAS à chaînes ultracourtes dans les échantillons d’eaux
Analyse directe et simultanée des PFAS à chaînes ultracourtes, à chaînes longues et alternatifs
Résumé
Le renforcement de la surveillance dans les eaux potables et non potables d’un nombre plus important de PFAS oblige à une méthodologie plus efficace. Ici, nous avons développé une approche unique permettant l’analyse simultanée des PFAS à chaînes ultracourtes (C2, C3), à chaînes moyennes (C4 – C8), à chaînes longues (> C8) et alternatifs, éliminant le besoin de méthodes séparées. Les résultats des expériences de validation sont présentés.
Introduction
Les substances per- et polyfluoroalkylées (PFAS) à chaînes ultracourtes (C2 et C3) sont des petites molécules très polaires qui contribuent à plus de 40% du total des PFAS détectés dans les eux environnementales (ex : eaux pluviales, eux fluviales, eaux souterraines) [1, 2, 3].
Les PFAS à chaînes ultracourtes comprennent l’acide trifluoroacétique (TFA), l’acide perfluoropropanoïque (PFPrA), le sulfonate de perfluoroéthane (PFEtS) et le sulfonate de perfluoropropane (PFPrS), le TFA étant le plus présent (abondant) et le plus difficile à analyser par chromatographie. Les méthodes actuelles de surveillance des PFAS ne traitent pas de ces nouveaux composés d’intérêt à chaînes ultracourtes en raison de leur rétention insuffisante sur des colonnes de phase inverse. D’autre part, les méthodes analytiques par chromatographie d’échange d’anions ont souvent trop de rétention et montrent de faibles performances chromatographiques pour les PFAS à chaînes ultracourtes. Et le défi devient encore plus grand lorsque l’on souhaite analyser simultanément les PFAS à chaînes ultracourtes, à chaînes longues et alternatifs sur une seule méthode.
Pour dépasser ces limites, nous avons utilisé une nouvelle colonne hybride HILIC/Échange Ionique (Raptor Polar X) pour développer une méthode LC-MS/MS simple et rapide pour l’analyse des PFAS à chaînes C2 à C8 et des PFAS alternatifs. Grâce à ses mécanismes multimodes de rétention, la colonne permet l’analyse simultanée des PFAS à chaînes ultracourtes et à chaînes longues, sur une seule et même méthode isocratique. Cette méthode d’injection directe a été évaluée par des analyses de précision et de justesse d’échantillons d’eaux dopées (eau du robinet, eau fluviale, eau souterraine et eau provenant d’ouvrages de travaux publics (effluents des eaux usées). Comme démontré ici, la méthode fournit une configuration et des conditions favorables à une haute cadence d’analyse pour les laboratoires d’analyses environnementales intéressés par l’ajout des PFAS à chaînes ultracourtes à leur analyse actuelle des PFAS.
Expérience
Méthode chromatographique :
Les conditions chromatographiques étaient les suivantes. Les transitions et le standard interne utilisés pour chaque analyte sont indiqués
dans le Tableau I.
| Column: | Raptor Polar X (2.7 µm, 50 mm x 2.1 mm ID [cat.# 9311A52]) | |
| Column temp.: | 40 °C | |
| Injection volume: | 10 µL | |
| Mobile phase A: | Water, 10 mM ammonium formate, 0.05% formic acid | |
| Mobile phase B: | Acetonitrile:methanol (60:40), 0.05% formic acid | |
| Time (min) | %B | |
| 0.00 | 85 | |
| 8.00 | 85 | |
| Flow rate: | 0.5 mL/min | |
| Ion mode: | Negative ESI | |
| Mode: | MRM | |
Tableau I : Transitions MS des analytes pour l’analyse simultanée des PFAS à chaînes ultracourtes, à chaînes longues, et alternatifs, dans les échantillons d’eaux.
| Analyte | Ion Parent (Précurseur) |
Ion Fils (Produit) |
SI pour la Quantification |
|---|---|---|---|
| TFA | 113.03 | 69.01 | 13C2-PFHxA |
| PFPrA | 163.03 | 119.01 | 13C2-PFHxA |
| PFBA | 212.97 | 168.97 |
13C2-PFHxA |
| PFHxA | 312.97 | 268.90 |
13C2-PFHxA |
| PFOA | 412.90 | 368.91 | 13C2-PFOA |
| HFPO-DA | 284.97 | 168.92 | 13C2-PFOA |
| ADONA | 376.90 | 250.93 | 13C2-PFOA |
| PFEtS | 198.98 | 79.92 | 13C3-PFBS |
| PFPrS | 248.97 | 79.98 | 13C3-PFBS |
| PFBS | 298.97 | 79.97 | 13C3-PFBS |
| PFHxS | 398.90 | 79.97 | 13C3-PFBS |
| PFOS | 498.84 | 79.97 | 13C4-PFOS |
| 9Cl-PF3ONS | 530.78 | 350.85 | 13C4-PFOS |
| 11Cl-PF3OUdS | 630.78 | 450.80 | 13C4-PFOS |
| 13C2-PFHxA | 314.97 | 269.93 | - |
| 13C2-PFOA | 414.90 | 369.87 | - |
| 13C3-PFBS | 301.90 | 79.97 | - |
| 13C4-PFOS | 502.84 | 79.97 | - |
Préparation des échantillons
Dans un flacon en polypropylène (utilisé pour diminuer la contamination), 250 μL de chaque échantillon d’eau ont été mélangés avec 250 μL de méthanol et 5 μL d’une solution de standards internes (10 ng/mL de 13C2-PFHxA, 13C2-PFOA, 13C3-PFBS, 13C4-PFOS dans le méthanol). Le flacon a été fermé avec un bouchon en polyéthylène cap (une fois de plus, pour réduire la contamination) pour injection et analyse.
Les standards utilisés pour la calibration ont été préparés en utilisant de l’eau désionisée (générée par un système Thermo Scientific Barnstead E-Pure) et la dopant avec les 14 analytes sur une gamme de 10 à 800 ng/L. Les solutions standards ont ensuite été diluées 1:1 dans du méthanol en suivant la procédure de préparation d’échantillon ci-dessus.
Un échantillon d’eau du robinet provenant des installations Restek et trois échantillons d’eaux (eau fluviale de Chicago, eau souterraine et eau d’effluents) fournis par l’Agence Américaine de Protection de l’Environnement (U.S. EPA) ont été dopés à 40 et 160 ppt. Les blancs et les échantillons d’eau dopés ont été dilués 1:1 dans du méthanol (comme décrit ci-dessus) avant analyse chromatographique et quantification grâce aux standards. Pour l’analyse du TFA dans l’eau souterraine, l’échantillon a été dilué cinq fois avec de l’eau désionisée avant d’être dopé à 40 et 160 ppt, en raison de sa concentration élevée en TFA.
Résultats & Discussion
Performances Chromatographiques
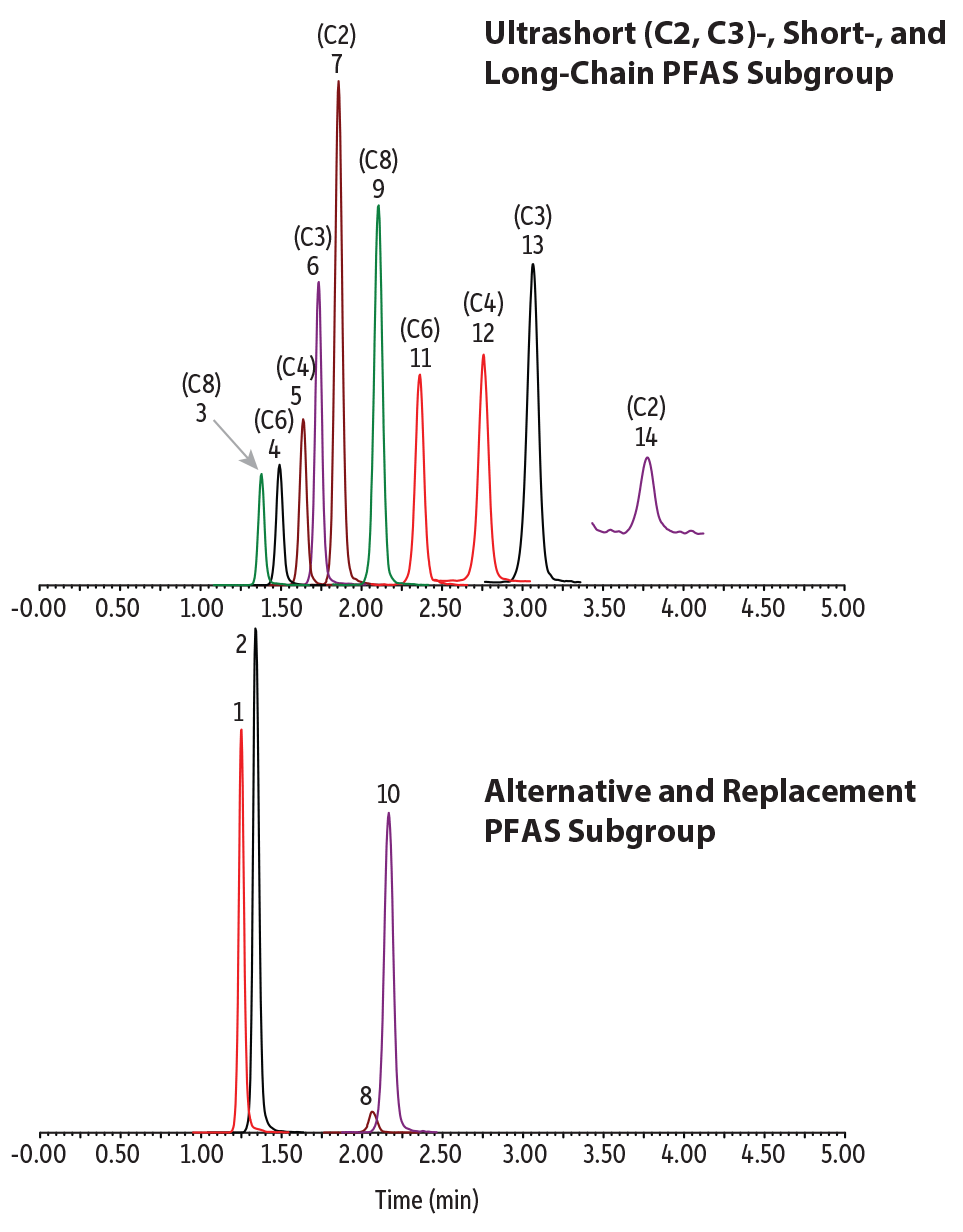
Une méthode isocratique a été développée permettant une analyse simple, rapide, et surtout simultanée des PFAS à chaînes ultracourtes, à chaînes longues et alternatifs, dans les échantillons d’eaux. Tous les analytes sont élués en 4 minutes, avec une rétention équilibrée et de bonnes formes de pics (Figure 1). Aucune interférence provenant des matrices n’a été observée dans aucun des échantillons d’eau en utilisant un cycle de 8 minutes. Comme cela sera discuté ci-dessous, le palier d’environ 4 minutes après le dernier composé élué s’est avéré nécessaire pour éviter d’éventuelles interférences provenant des matrices.
Figure 1 : Chromatogramme d’un standard à 400 ng/l.
Linéarité
La gamme d’étalonnage est de 20 à 800 ppt pour le TFA et de 10 à 800 ppt pour les autres analytes. Quatre standards internes ont été évalués pour déterminer la courbe d’étalonnage la plus appropriée pour les différents analytes. Tous les composes ont montré une linéarité acceptable avec des valeurs de r2 >0.996 et des écarts <20% (en utilisant une régression quadratique pondéré 1/x).
Justesse et Précision
Dans nos expériences initiales, une interférence matricielle a été observée ai niveau du signal du TFA, lorsque les échantillons d’eaux étaient analysés en utilisant un cycle isocratique de 5 minutes.
Différents temps d’analyse ont été testés et il a été déterminé qu’un cycle de 8 minutes était nécessaire pour éviter ces interférences provenant des matrices. La durée du palier isocratique peut devoir être modifiée en fonction de l’instrumentation utilisée et/ou des échantillons à analyser.
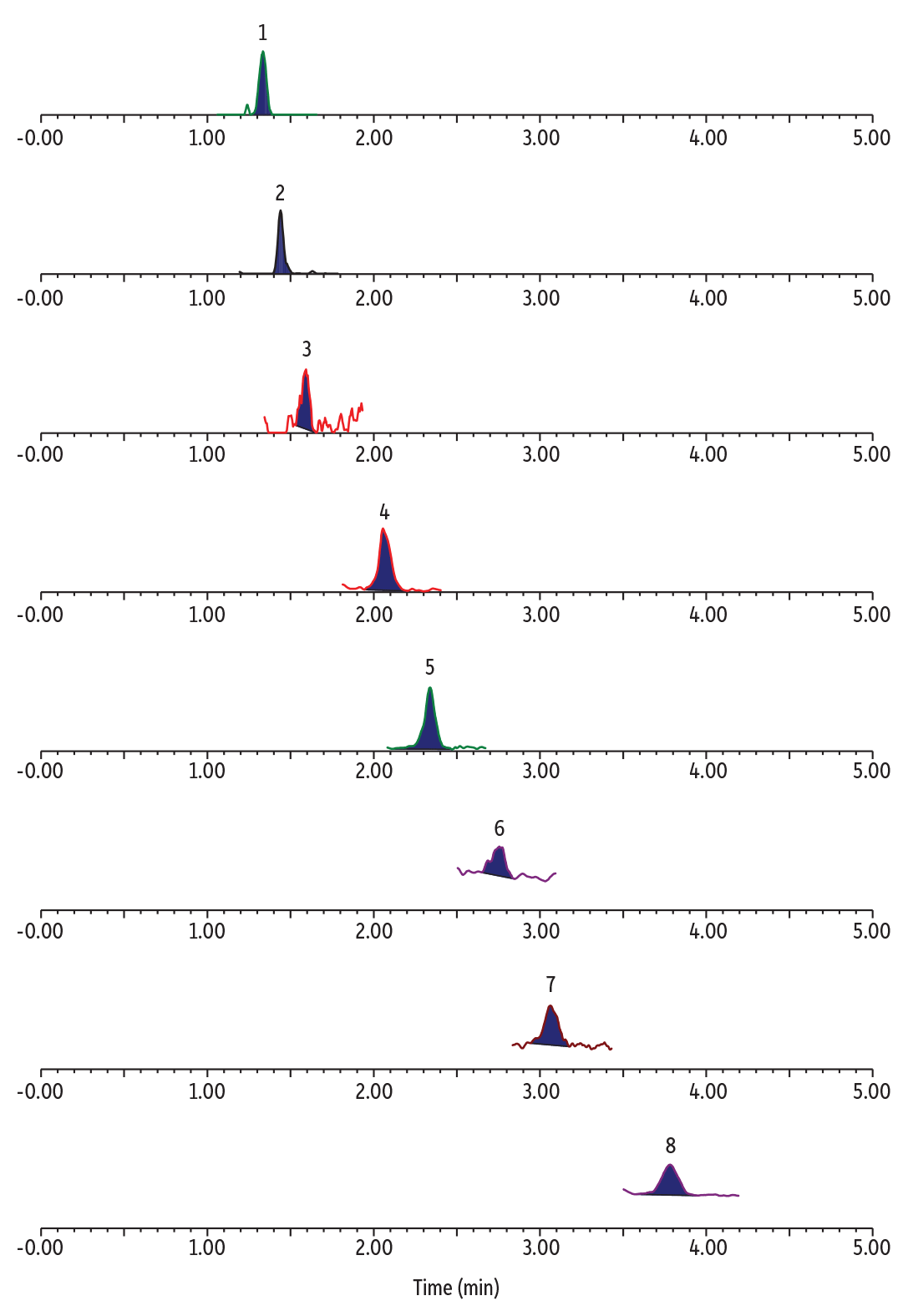
Les blancs ont montré divers niveaux de TFA et des PFAS en C3, C4, C6, et C8, sans ADONA, HFPO-DA, 9Cl-PF3ONS et 11Cl-PF3OUdS détectables (Tableau II). Un exemple d’un chromatogramme pour l’analyse simultanée des PFAS à chaînes ultracourte, à chaînes longues et alternatifs, dans un échantillon blanc d’eau d’effluents, est montré en Figure 2.
Tableau II : Analytes détectables dans les échantillons blancs
| Detected Concentration (ng/L) | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Samples | TFA | PFPrA | PFBA |
PFHxA |
PFOA | HFPO-DA | ADONA | PFEtS | PFPrS | PFBS | PFHxS | PFOS | 9Cl-PF3ONS | 11Cl-PF3OUdS |
| Tap Water |
164.2 |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
| River Water |
193.3 |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
| Groundwater |
1425 |
ND |
ND |
ND |
5.4 |
ND |
ND |
ND |
ND |
6.7 |
3.9 |
ND |
ND |
ND |
| POTW Water |
352.8 |
9.6 |
15.3 |
93.5 |
20.4 |
ND |
ND |
ND |
ND |
6.8 |
6.7 |
9.6 |
ND |
ND |
ND: non-detectable
Figure 2: Detectable PFAS in blank POTW water.
Pour déterminer la justesse (pourcentage de rendement), les quantités mesurées dans les échantillons dopes ont été ajustés pour tenir compte de la concentration dans les blancs. Les échantillons d’eaux ont été dopés à faible et forte concentration, en double, pour chaque série analytique. Trois séries analytiques ont été mesurées sur des jours différents. Le tableau III montre les résultats de justesse et précision calculés à partir des trois séries de données. La justesse de la méthode dans les échantillons d’eaux a été démontrée par des valeurs de rendement se situant à moins de 30% de la concentration nominale pour les niveaux dopés et de limite de quantification. L’écart-type relative était <20%, montrant une précision de méthode acceptable pour l’analyse simultanée des PFAS à chaînes ultracourtes, à chaînes longues et alternatifs, dans les échantillons d’eaux.
Tableau III : Précision et Justesse de la Méthode
| %Précision Moyen (%RSD) | |||||||||
| Matrices | Eau du robinet | Eau fluviale | Eau souterraine** | Eau d’effluents (POTW) | Eau déionisée | ||||
|
Conc. (ng/L) |
40 |
160 |
40 |
160 |
40 |
160 |
40 |
160 |
10* |
|
TFA |
106 (16.9) |
97.9 (7.10) |
97.4 (10.8) |
97.6 (6.12) |
97.5 (14.5) |
103 (8.87) |
102 (17.1) |
96.4 (7.33) |
107 |
|
PFPrA |
95.1 (4.08) |
105 (3.48) |
94.5 (6.85) |
104 (2.36) |
103 (9.37) |
105 (8.34) |
91.8 (4.90) |
104 (7.09) |
109 |
|
PFBA |
106 (6.80) |
117 (3.18) |
105 |
114 (4.91) |
111 (2.48) |
120 (3.27) |
106 (6.58) |
114 (4.85) |
104 |
|
PFHxA |
93.3 (7.41) |
111 (2.61) |
91.8 (11.34) |
103 (4.55) |
102 (6.62) |
109 (7.11) |
103 (8.37) |
108 (3.13) |
115 |
|
PFOA |
100 (4.24) |
107 (3.14) |
103 |
105 (2.64) |
92.6 (3.85) |
107 (3.09) |
102 (4.57) |
109 (3.64) |
106 |
|
HFPO-DA |
95.7 (11.9) |
108 (9.05) |
86.6 (8.97) |
104 (5.45) |
94.1 (18.6) |
105 (9.35) |
95.2 (8.49) |
106 (9.23) |
102 |
|
ADONA |
106 (3.75) |
116 (2.38) |
100 |
110 (4.59) |
104 (4.91) |
113 (5.23) |
111 (5.26) |
115 (2.65) |
105 |
|
PFEtS |
94.8 (9.68) |
110 (5.39) |
89.4 (7.43) |
102 (9.76) |
96.5 (4.09) |
108 (6.11) |
104 (8.18) |
109 (5.23) |
99.8 |
|
PFPrS |
104 (4.97) |
115 (4.19) |
95.0 (3.87) |
107 (4.26) |
106 (10.6) |
114 (3.36) |
111 (4.88) |
114 (2.96) |
108 |
|
PFBS |
97.4 (10.1) |
113 (3.97) |
93.6 (5.24) |
104 (4.19) |
97.8 (4.47) |
107 (4.23) |
94.1 (10.7) |
108 (4.48) |
100 |
|
PFHxS |
99.4 (15.7) |
114 (3.56) |
94.3 (9.79) |
104 (5.28) |
95.2 (5.63) |
112 (3.20) |
104 (8.19) |
111 (4.07) |
107 |
|
PFOS |
104 (7.54) |
107 (7.69) |
103 |
105 (7.23) |
97.3 (14.9) |
110 (4.84) |
109 (7.47) |
108 (7.53) |
102 |
|
9Cl-PF3ONS |
98.7 (3.52) |
105 (8.35) |
91.8 (7.66) |
103 (5.68) |
94.7 (9.83) |
105 (8.90) |
105 (6.76) |
107 (8.27) |
107 |
|
11Cl-PF3OUdS |
106 (10.1) |
113 (3.54) |
95.0 (3.52) |
113 (8.15) |
107 (6.61) |
112 (4.54) |
119 (4.25) |
120 (9.10) |
98.2 |
*LLOQ de 20 ng/L pour le TFA
**L’eau souterraine a été diluée 5 fois uniquement pour le TFA
Conclusion
Une méthode isocratique simple a été développée et validée pour l’analyse simultanée des PFAS à chaînes ultracourtes, à chaînes longues et alternatifs, dans les échantillons d’eaux. Grâce aux différents mécanismes d’interaction et de rétention entre ces analytes et la colonne Raptor Polar X (2.7 μm) de 2.1 x 50 mm, la méthode analytique s’est démontrée être rapide, robuste et sensible avec une précision et une justesse acceptables. Cette méthode est parfaite pour les laboratoires d’analyse souhaitant développer leurs dosages actuels de PFAS dans les eaux potables et non potables en y incluant les composés en C2 et C3.
Références
- S. Taniyasu, K. Kannan, L.W.Y. Yeung, K.Y. Kwok, P.K.S Lam, N. Yamashita, Analysis of trifluoroacetic acid and other short-chain perfluorinated acids (C2-C4) in precipitation by liquid chromatography-tandem mass spectrometry: comparison to patterns of long-chain perfluorinated acids (C5-C18), Anal. Chim. Acta. 619 (2008) 221-230. https://pubmed.ncbi.nlm.nih.gov/18558116/
- J. Janda, K. Nodler, H-J. Brauch, C. Zwiener, F.T. Lange, Robust trace analysis of polar (C2-C8) perfluorinated carboxylic acids by liquid chromatography-tandem mass spectrometry: method development and application to surface water, groundwater, and drinking water, Environ. Sci. Pollut.R. 26 (2018) 7326-7336. https://pubmed.ncbi.nlm.nih.gov/29557039/
- K.Y. Kwok, S. Taniyasu, L.W.Y. Yeung, M.B. Murphy, P.K.S. Lam, Y. Horii, K. Kannan, G. Petrick, R.K. Sinha, N. Yamashita, Flux of perfluorinated chemicals through wet deposition in Japan, the United States, and other countries, Environ. Sci. Technol. 44 (2010) 7043-7049. https://pubmed.ncbi.nlm.nih.gov/20795671/